Introduction
Les encéphalites sont des maladies inflammatoires de l’encéphale, constitué du cerveau, du cervelet et du tronc cérébral (Fig. 1). Les étiologies des encéphalites sont multiples : d’origine infectieuse (bactérienne, virale, parasitaire ou mycosique) ou d’origine immunologique (paranéoplasie, auto-immunité). Le diagnostic étiologique reste malheureusement inconnu dans près de la moitié des encéphalites. En Europe, l’encéphalite herpétique, liée au virus de l’Herpes simplex est la plus représentée puisqu’elle concerne environ 50 % des méningo-encéphalites identifiées. D’autres virus, comme le virus de la varicelle et du zona, le virus d’Epstein-Barr, le cytomégalovirus, les entérovirus, le West-Nile, l’encéphalite japonaise, le VIH, la rougeole et les oreillons sont également responsables d’inflammation cérébro-méningée. Depuis 2019, le SARS-CoV-2 doit également être considéré. La rage et les virus émergents (Hendra, Nipah) peuvent être évoqués selon le contexte. Parmi les étiologies bactériennes : les bactéries communautaires, la tuberculose, les rickettsies, les borrélioses ou les listérioses sont les plus représentées. Parmi les étiologies parasitaires, le paludisme et les trypanosomoses peuvent être évoqués. (Tab. 1).
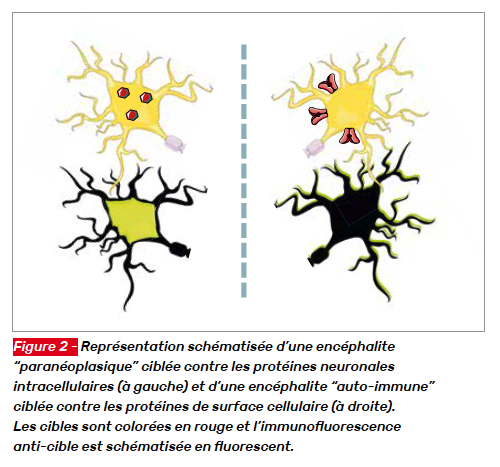
Si les encéphalites d’origine infectieuse doivent faire partie du bilan étiologique de toute encéphalite, il existe de nombreux types d’encéphalites à médiation immunitaire : les encéphalites paranéoplasiques, classiquement associées à des anticorps dirigés contre des protéines intracellulaires neuronales (anticorps anti-onconeuronaux ou anti-neurones), font partie de ces encéphalites médiées par l’immunité et s’opposent ou complètent les encéphalites dites “auto-immunes” associées à des anticorps dirigés contre des protéines de surface cellulaire neuro-nogliales, des canaux ioniques ou des récepteurs. Si les encéphalites paranéoplasiques sont toujours liées à une pathologie cancéreuse, les encéphalites auto-immunes sont associées de manière variable à la présence ou non d’une néoplasie.
Les termes « paranéoplasiques » et « auto-immunes » sont trompeurs puisque les encéphalites paranéoplasiques sont liées à une dysimmunité et que les encéphalites auto-immunes peuvent être paranéoplasiques. Comme pour la littérature, nous préciserons dans ce dossier les encéphalites liées à des anticorps dirigés contre des antigènes intracellulaires neuronaux (anti-onconeuronaux ou anti-neurones) et celles liées à des anticorps dirigés contre les antigènes de surface cellulaire neurono-gliale (encore appelés anti-neuropiles puisque dirigés contre les “poils” neuronaux) (Fig. 2).
Dans les encéphalites auto-immunes, les anticorps se lient à des protéines de surface cellulaire et provoquent un dysfonctionnement cérébral supposé réversible. A contrario, dans les encéphalites paranéoplasiques, où les anticorps sont dirigés contre les protéines intracellulaires, la perte neuronale est fréquente en lien avec une immunité cellulaire T cytotoxique. La perte neuronale, irréversible, explique les moins bons résultats obtenus dans le traitement des encéphalites paranéoplasiques en comparaison avec les encéphalites auto-immunes malgré des présentations cliniques parfois très proches.
Ces tableaux médiés par l’immunité sont à différencier des maladies auto-immunes classiques qui peuvent toucher le système nerveux (lupus érythémateux disséminé…). Les syndromes encéphalitiques peuvent toucher des personnes de tout âge et sont parfois identifiables par le tableau clinique qu’ils occasionnent. Malgré l’intensité et la gravité des symptômes, le diagnostic et la prise en charge rapide peuvent conduire à une amélioration clinique, voire à la guérison.
Mécanismes physiopathologiques
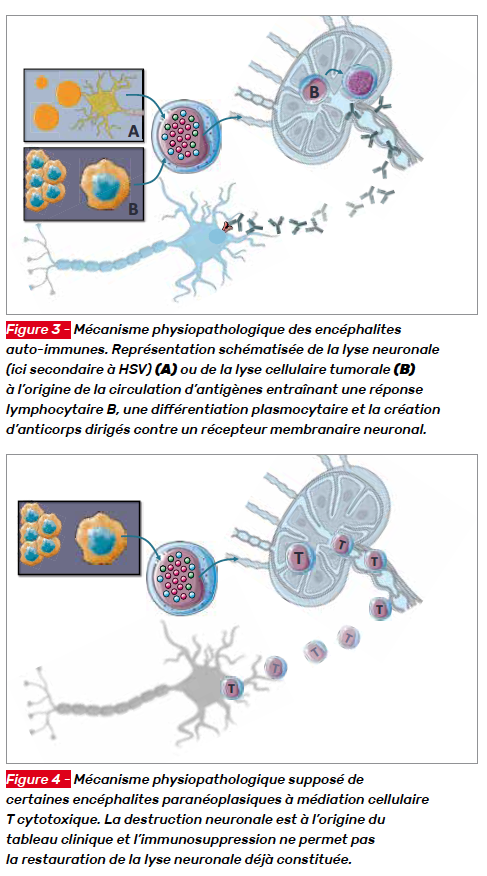
Les modes de déclenchement de la réponse inflammatoire responsable des syndromes encéphalitiques commencent à être élucidés. Le postulat de départ comprend l’initiation de la réponse immunitaire par la destruction neuronale (Fig. 3A), par exemple secondaire à une encéphalite infectieuse ou la lyse de cellules tumorales peu différenciées porteuses d’antigènes proches des cellules neuronales (Fig. 3B). Les deux phénomènes sont responsables de la circulation d’antigènes intracellulaires neuronogliaux ou d’antigènes de surface ; en cas de lyse neuronale ou d’antigènes multiples en cas de lyse tumorale.
Dans le cas des encéphalites auto-immunes, ces antigènes sont ensuite adressés à des cellules B mémoires qui atteignent le cerveau. Elles subissent, après une stimulation, une maturation d’affinité induite par les antigènes, une expansion clonale, une différenciation plasmocytaire et génèrent des anticorps dirigés contre les antigènes de surface des neurones à l’origine de leur dysfonctionnement (Fig. 3). Dans ce mécanisme, il n’y a pas de destruction neuronale associée à l’auto-immunité et la fonction neuronale peut être rétablie avec la suppression de l’anticorps agresseur. [2]
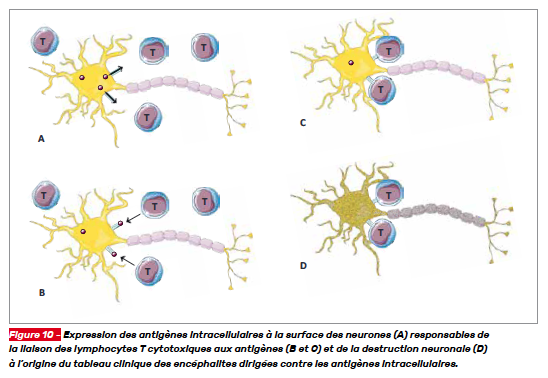
Dans le cas des encéphalites paranéoplasiques, la lyse tumorale entraîne la circulation d’antigènes de cellules peu différenciées dont certains miment les antigènes intracellulaires neuronaux. S’en suit alors une réponse immunitaire cellulaire à l’origine de la production et de la stimulation de cellules T cytotoxiques. Les cellules immunitaires cytotoxiques sont ensuite dirigées contre les neurones à l’origine de leur destruction. Dans ce mécanisme, la suppression de l’anticorps agresseur ne permet pas toujours l’amélioration clinique du fait de la destruction neuronale déjà constituée (Fig. 4).
Démarche diagnostique
Diagnostic d’un syndrome encéphalitique
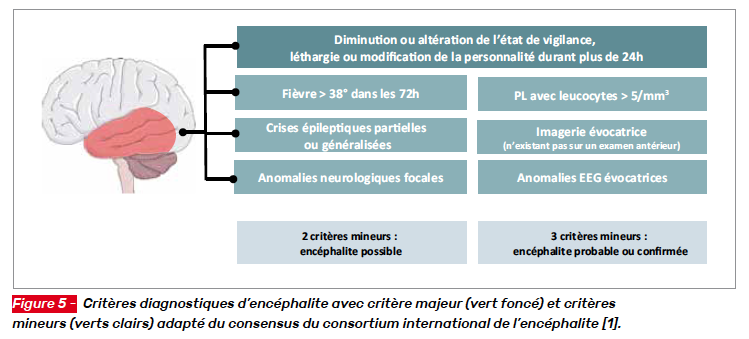
Le diagnostic définitif des encéphalites paranéoplasiques ou auto-immunes repose sur la détection dans le sérum ou dans le liquide cérébrospinal (LCS) d’auto-anticorps spécifiques. L’évocation d’un syndrome encéphalitique se fait facilement devant l’association d’un tableau neurologique central et d’une fièvre qui est malheureusement souvent manquante. L’existence de troubles du comportement, de troubles de la vigilance, de troubles mnésiques d’apparition aiguë ou subaiguë sont évocateurs. L’apparition de crises convulsives ou de signes neurologiques focaux est aussi un mode d’entrée dans le diagnostic. Des critères cliniques pour faciliter le diagnostic ont été établis par un consortium international sur l’encéphalite (Fig. 5).
Selon le Consensus Statement of the International Encephalitis Consortium, le diagnostic d’encéphalite nécessite la présence d’un critère clinique majeur qui correspond à une altération de l’état mental marquée par une diminution de l’état de vigilance, une léthargie ou une modification de la personnalité qui dure plus de 24 h sans cause alternative identifiée. À ce critère majeur sont associés des critères mineurs dont l’existence d’une fièvre ≥ 38°C dans les 72 h qui entourent la présentation clinique, de crises convulsives partielles ou généralisées non liées à une maladie épileptique préalable, l’apparition d’anomalies neurologiques focales, un LCS avec une leucocytose ≥ 5/mm3, une anomalie du parenchyme cérébral n’existant pas sur une imagerie antérieure ou une anomalie électroencéphalographique évocatrice. La présence du critère majeur et de deux critères mineurs rendent l’encéphalite possible, et la présence du critère majeur et de trois ou plus critères mineurs rendent l’encéphalite probable ou confirmée [1].
Une fois le diagnostic d’encéphalite évoqué, il est essentiel d’envisager toutes les étiologies des syndromes encéphalitiques : premièrement parce que de nombreuses décisions thérapeutiques doivent être prises avant que les résultats de tests de confirmation des anticorps soient disponibles et secondairement parce que les étiologies infectieuses doivent être exclues avant d’envisager les thérapies immunosuppressives des encéphalites paranéoplasiques ou auto-immunes.
Diagnostics différentiels des encéphalites paranéoplasiques ou auto-immunes
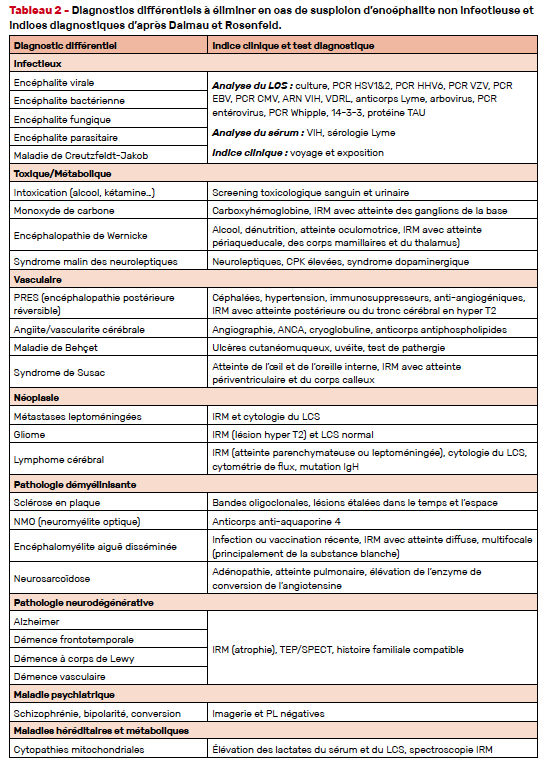
Les diagnostics différentiels des encéphalites non infectieuses comprennent bien évidemment les encéphalites infectieuses déjà évoquées en introduction. Il convient également d’éliminer les pathologies vasculaires, toxiques, métaboliques, les néoplasies intracérébrales, les pathologies démyélinisantes, les troubles neurodégénératifs, les troubles héréditaires et les maladies psychiatriques (Tab. 2).
Certaines encéphalites auto-immunes ont des présentations psychiatriques au premier plan qui mènent les patients atteints en unité de soins psychiatriques. L’examen neurologique précis, l’analyse du LCS ou l’imagerie cérébrale sont alors déterminants pour réorienter précocement ces patients qui ne présenteront des symptômes plus évocateurs que parfois tardivement.
Examens complémentaires
La suspicion clinique d’encéphalite paranéoplasique ou auto-immune doit faire réaliser chez les patients une imagerie encéphalique, un électroencéphalogramme, une ponction lombaire et une analyse du sérum pour confirmer le diagnostic et éliminer les diagnostics différentiels.
L’imagerie par résonance magnétique (IRM) cérébrale
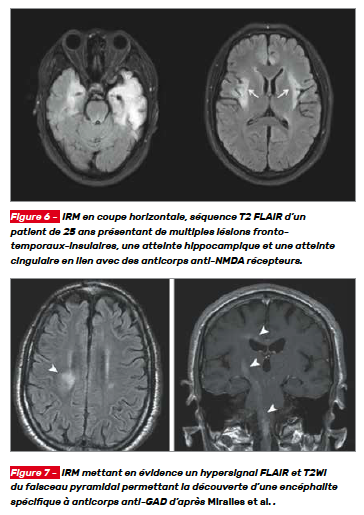
L’IRM cérébrale permet l’exclusion des pathologies vasculaires, néoplasiques et métastatiques notamment. Chez les patients atteints d’encéphalite paranéoplasique ou auto-immune on retrouve des hyperintensités T2 et T2 FLAIR (Fluid attenuated inversion recovery) dans les régions cérébrales touchées par l’inflammation (Fig. 6). Les régions cérébrales les plus touchées sont les lobes temporaux médians et le tronc cérébral, mais les régions sous-corticales et le cervelet peuvent être concernés. En plus de préciser le diagnostic syndromique, l’IRM peut être utile dans l’évocation de syndrome spécifique en fonction de l’anomalie visualisée (Fig. 7).
L’électroencéphalogramme (EEG)
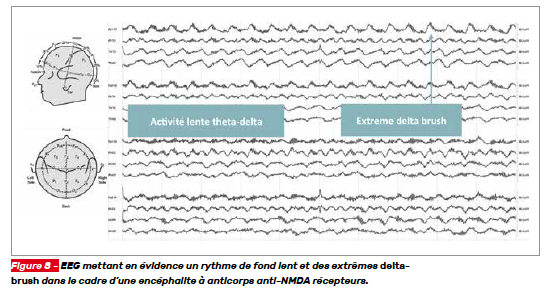
L’EEG doit être réalisé dès la suspicion diagnostique pour exclure des crises infracliniques. Chez les patients atteints d’encéphalite, plusieurs anomalies non spécifiques de l’EEG peuvent être mises en évidence comme le ralentissement focal ou généralisé, l’activité épileptiforme et les décharges épileptiformes périodiques latéralisées (PLEDs). Certaines anomalies spécifiques peuvent également être mises en évidence comme les extrêmes delta-brush (brosses extrêmes delta) qui sont caractéristiques des encéphalites à anticorps anti-NMDA récepteurs (Fig. 8)
L’analyse du LCS (hors panel des anticorps)
L’analyse du LCS doit comprendre une numération cellulaire, le dosage du glucose et des protéines. L’indice IgG et l’existence de bandes oligoclonales doivent être recherchés. Des tests de panel d’anticorps pour les encéphalites paranéoplasiques ou auto-immunes, des études virales larges (PCR HSV et VZV notamment), des cultures bactériennes et fongiques, et une étude anatomopathologique peuvent également être réalisés. La normalité du LCR n’exclut pas formellement le diagnostic. L’existence d’une protéinorachie modérée (< 100 mg/dl), d’une pléiocytose lymphocytaire légère à modérée, d’un indice IgG élevé ou de bandes oligoclonales est évocatrice. L’absence d’inflammation du LCR augmente avec l’âge du patient.
La recherche d’un cancer associé
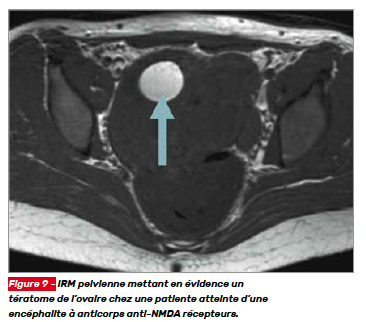
La recherche d’un cancer associé doit être envisagée si le diagnostic d’encéphalite paranéoplasique ou auto-immune est suspecté. La localisation de la tumeur peut même constituer un indice sur le syndrome encéphalitique responsable du tableau neurologique. De manière probabiliste, la recherche d’un cancer bronchopulmonaire ou d’une tumeur abdomino-pelvienne peut avoir un intérêt dans la démarche diagnostique (Fig. 9).
La recherche d’anticorps spécifiques
La recherche d’anticorps spécifiques des encéphalites paranéoplasiques ou auto-immunes peut être effectuée dans le sérum ou dans le LCS. La découverte de nouveaux anticorps et cibles est constante et l’absence de résultat n’exclut pas le diagnostic.
La spécificité des anticorps est détaillée plus loin dans ce dossier, mais quatre principes généraux concernant leur recherche s’appliquent. 1- Il convient notamment d’effectuer une recherche simultanée d’anticorps dans le sérum et dans le LCS et de ne pas attendre que les tests du sérum soient négatifs avant de tester le LCS au risque de retarder le diagnostic. 2- En cas de diagnostic sérique positif, mais de LCS négatif, il faut recontacter le laboratoire et demander une nouvelle analyse pour ne pas prendre en compte un diagnostic faussement positif. 3- Un tableau clinique ne correspondant pas à l’anticorps retrouvé doit également faire reconsidérer le diagnostic et demander une nouvelle analyse. 4- La prise en charge doit être fondée sur la clinique et non sur le titre des anticorps.
Encéphalites paranéoplasiques (cible intracellulaire neuronale)
Pour rappel, les encéphalites paranéoplasiques sont liées à des anticorps dirigés contre des antigènes intracellulaires neuronaux (anti-onconeuronaux ou anti-neurones) (Fig. 10).
Caractéristiques cliniques
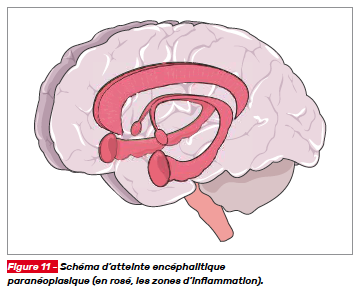
Les encéphalites paranéoplasiques peuvent se présenter sous la forme d’une encéphalomyélite (avec atteinte médullaire associée), d’une atteinte exclusive du tronc cérébral ou d’une encéphalite limbique (hippocampique, amygdalienne, cingulaire, fornicale…) (Fig. 11). Dans la plupart des cas, les symptômes apparaissent de manière aiguë ou subaiguë. Chez plus de 50 % des patients, les signes neurologiques apparaissent alors que le diagnostic de cancer n’est pas connu [3].
Encéphalite limbique
L’encéphalite limbique est marquée par des modifications du comportement et de l’humeur et par l’apparition d’une amnésie antérograde. Les crises partielles complexes et les troubles cognitifs font également partie du tableau clinique classique. Des atteintes neurovégétatives médiées par l’hypothalamus peuvent également être retrouvées comme l’hyperthermie et les anomalies endocriniennes. Les cancers les plus souvent associés aux encéphalites limbiques sont les cancers pulmonaires (petites cellules), les tumeurs testiculaires, les thymomes, les cancers du sein et les lymphomes de Hodgkin.
Encéphalite du tronc cérébral
L’encéphalite du tronc cérébral est fréquemment associée à une atteinte limbique, myélique ou cérébelleuse. Le terme de « rhombencéphalite » est souvent utilisé à tort pour l’ensemble des encéphalites du tronc cérébral alors que le mésencéphale ne dérive pas du rhombencéphale contrairement au bulbe, au pont, au cervelet et au 4e ventricule. Les atteintes de la motricité oculaire, les opsoclonies, le nystagmus, les dysphagies hautes, les dysarthries périphériques, les surdités de perception, les déficits sensitifs et sensoriels de la face, les vertiges, les troubles du contrôle cardiaque et du rythme respiratoire doivent faire envisager une atteinte du tronc cérébral en lien avec l’atteinte des noyaux ou de la racine des nerfs crâniens correspondants ou des noyaux végétatifs. Le coma par atteinte réticulée est également une présentation extrême d’encéphalite du tronc cérébral. Les cancers pulmonaires (à petites cellules), testiculaires, du sein, rénal, prostatique sont les plus représentés dans ce type d’encéphalite.
Encéphalomyélite
Les encéphalomyélites paranéoplasiques sont marquées par des atteintes de la moelle spinale, des ganglionopathies et du système nerveux autonome. Les ataxies proprioceptives et les pertes de sensations vibratoires doivent faire évoquer le diagnostic d’atteinte lemniscale. L’examen de la sensibilité est déterminant dans ce type d’atteinte. Toutes les tumeurs peuvent être retrouvées en association avec les encéphalomyélites, mais le cancer pulmonaire à petites cellules est retrouvé dans plus de 75 % des cas.
Examens complémentaires
L’EEG permet la découverte de ralentissements focaux ou généralisés en association avec des activités épileptiformes principalement retrouvés au niveau des régions temporales dans les encéphalites paranéoplasiques.
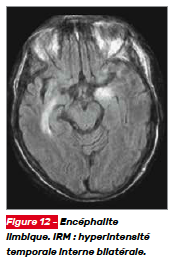
L’IRM cérébrale en T2 FLAIR met en évidence une hyperintensité de la partie médiale des lobes temporaux (Fig. 12). Ces signaux sont sensibles, mais ne sont pas spécifiques des encéphalites paranéoplasiques. Une atteinte du tronc cérébral, du cervelet ou de la moelle spinale peut également être mise en évidence en IRM selon la présentation clinique.
La tomographie par émission de positron (TEP) peut dépister un hypermétabolisme des régions temporales internes en cas d’encéphalite limbique.
Anticorps spécifiques anti-neurones (anti-onconeuronaux)
Anticorps anti-Hu
Les anticorps anti-Hu sont dirigés contre des protéines de liaison retrouvées dans le cytoplasme et le noyau des neurones du système nerveux central et périphérique.
Les syndromes encéphalitiques à anticorps anti-Hu sont souvent multifocaux et marqués par des atteintes temporales, du tronc cérébral, cérébelleuses, des racines dorsales, des ganglionopathies et du système nerveux autonome. Une atteinte ganglionnaire isolée ou une rhombencéphalite isolée doit également faire évoquer le diagnostic [4].
Les cancers pulmonaires à petites cellules sont retrouvés chez la plupart des patients présentant une encéphalite à anticorps anti-Hu. La découverte précoce d’anticorps anti-Hu et le traitement antitumoral rapide sont essentiels dans la stabilisation, voire l’amélioration du pronostic neurologique. La défaillance neurologique associée à ces encéphalites est souvent responsable de la mortalité précoce des patients.
Anticorps anti-Ma2
L’antigène Ma2 est classiquement exprimé dans les neurones et dans les tumeurs testiculaires. Les anticorps anti-Ma2 (ou anti-Ta) sont responsables de tableaux encéphalitiques avec tropisme limbique, diencéphalique et du tronc cérébral isolés ou combinés. La clinique peut s’accompagner d’une somnolence diurne, de mouvements oculaires anormaux dont la parésie du regard vers le haut est la plus caractéristique. Les dyskinésies sont également un mode de présentation clinique.
Les encéphalites à anticorps anti-Ma2 sont associées aux tumeurs germinales testiculaires dont l’orchidectomie peut être nécessaire pour contrôler le syndrome neurologique.
Anticorps anti-CRMP5
Les syndromes encéphalitiques à anti-CRMP5 sont marqués par une atteinte cortico-limbique et sont parfois associés à une symptomatologie riche incluant des dyskinésies, des chorées, des atteintes des nerfs crâniens, un syndrome cérébelleux, des pertes sensorielles ou encore des neuropathies sensitivomotrices. Ils sont associés aux cancers pulmonaires à petites cellules et aux thymomes.
Anticorps anti-Ri
Les anticorps anti-Ri sont retrouvés chez des patients présentant une ataxie ou des opsoclonies. Ils peuvent être également responsables d’atteintes du tronc cérébral avec des anomalies des mouvements oculaires, des ptoses et des troubles de la déglutition. Un laryngospasme ou une dystonie des mâchoires sont également des modes de présentation.
Anticorps anti-amphiphysine
Le syndrome de l’homme raide asssocie une rigidité du tronc et des membres à des spasmes musculaires douloureux et est marqué par des sursauts excessifs à la stimulation. Les anticorps anti-amphiphysine sont classiquement retrouvés dans ces syndromes encéphalitiques, mais des tableaux similaires sont décrits avec des anti-GAD ou des anticorps anti-récepteurs à la glycine (anti-GlyR).
Anticorps anti-KLHL11
Les anticorps anti-protéine KLHL11 (de la famille des protéines Kelch, intervenant dans l’ubiquitinylation) sont parfois retrouvés dans des syndromes encéphalitiques cérébelleux ou du tronc cérébral. Ils peuvent être associés à des tumeurs testiculaires ou des tératomes bénins. Ils sont parfois retrouvés en association avec d’autres anticorps (anti-NMDA ou anti-Ma2 par exemple).
Autres cibles intracellulaires
D’autres cibles intracellulaires (Yo, CV2, Tr/DNER ou Sox1) sont également responsables de tableaux encéphalitiques plus ou moins spécifiques comme la dégénérescence cérébelleuse paranéoplasique (anti-Yo, anti-CV2, anti-Tr, anti-Sox), des atteintes ophtalmologiques (anti-CV2) ou même des syndromes myasthéniques (anti-Sox).
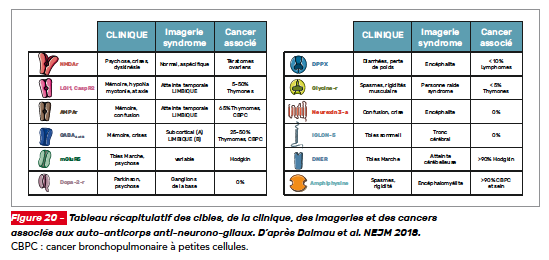
Encéphalites auto-immunes (antigènes de surface neurono-gliaux)
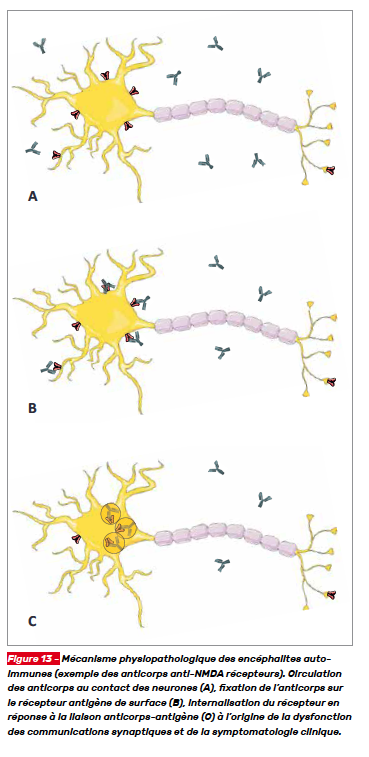
Pour rappel, les encéphalites auto-immunes sont dirigées contre des antigènes de surface neuronaux ou gliaux ou des protéines synaptiques (Fig. 13). Ces syndromes sont associés de manière variable à des cancers. La réponse aux thérapies immunomodulatrices est généralement bonne, ce qui implique que leur diagnostic et leur prise en charge rapide sont essentiels. La physiopathologie est déduite de celles des encéphalites à anticorps anti-N-méthyl-D-aspartate récepteurs (NMDA) qui sont les plus étudiées. [2]
Caractéristiques cliniques
Les encéphalites auto-immunes sont responsables de tableaux cliniques variés allant de l’encéphalite limbique typique à des symptômes complexes neurologiques ou neuropsychiatriques. Les troubles de la mémoire, les troubles cognitifs, les psychoses, les crises convulsives, les mouvements anormaux ou encore les troubles de la vigilance pouvant mener jusqu’au coma sont des modes de présentation de ces syndromes. Les caractéristiques cliniques de ces tableaux sont décrites dans les chapitres correspondant à chaque cible de surface.
Anticorps anti-NMDA récepteurs
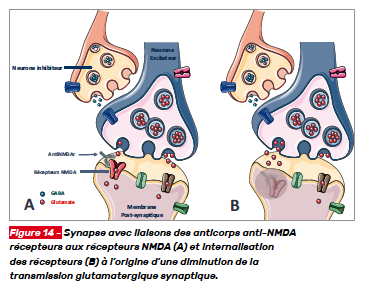
Les encéphalites à anticorps anti-NMDA récepteurs sont responsables d’un tableau syndromique caractéristique. L’internalisation des récepteurs est à l’origine d’un défaut de transmission synaptique excitatrice glutamatergique responsable de la symptomatologie (Fig. 14). [5]
Tableau clinique
La présentation clinique des encéphalites à anticorps anti-NMDA récepteurs est classiquement marquée par des céphalées et une fièvre rapidement suivies de plusieurs symptômes parmi lesquels des manifestations pseudo-psychiatriques sont au premier plan (anxiété, agitation, troubles du comportement, hallucinations, délires, psychose, oligophrénie). Les troubles du sommeil à type de réduction ou d’hypersomnie, les troubles de la mémoire, les crises d’épilepsie et les altérations de la conscience sont également retrouvés chez les patients atteints. Les dyskinésies orofaciales sont assez caractéristiques tout comme les dystonies ou la rigidité. Il existe également des manifestations neurovégétatives avec des dysrégulations thermiques, hémodynamiques, et parfois même respiratoires qui peuvent mener à la ventilation mécanique. Les troubles du langage (écholalie, mutisme) sont aussi retrouvés dans le tableau syndromique.
Diagnostic et examens complémentaires
L’analyse du LCS peut révéler une pléiocytose lymphocytaire ou des bandes oligoclonales, mais la normalité du LCS ne doit pas faire éliminer le diagnostic.
L’électroencéphalogramme peut mettre en évidence une activité épileptiforme, mais la présentation la plus fréquente est un ralentissement et une désorganisation du rythme qui n’est pas liée aux mouvements anormaux concomitants. La présence d’extrême delta-brush est caractéristique, mais rarement retrouvée et associée à une forme prolongée de la maladie [6].
L’IRM cérébrale peut être initialement normale ou présenter des hypersignaux FLAIR ou des prises de contrastes corticales et sous-corticales (hippocampique, des ganglions de la base ou encore de la substance blanche sous-corticale).
La découverte d’anticorps de type IgG anti-NMDA récepteurs dans le LCS signe le diagnostic. La recherche de ces anticorps dans le sérum peut être à l’origine de faux-positifs ou de faux-négatifs. Les IgM ou IgA anti-NMDA récepteurs ne sont pas spécifiques et n’ont pas de valeur dans le diagnostic d’encéphalite à anticorps anti-NMDA récepteurs : ils sont parfois retrouvés dans certaines schizophrénies chroniques ou dans d’autres troubles neurologiques chroniques. Une synthèse intrathécale est retrouvée chez la majorité des patients.
Associations tumorales
La découverte d’anticorps anti-NMDA récepteurs doit faire rechercher un tératome ovarien présent dans plus de 50 % des cas chez les patientes de plus de 18 ans. La recherche de tératome doit faire pratiquer une IRM ou une tomodensitométrie ou encore une échographie abdomino-pelvienne. Chez l’homme, la découverte d’une tumeur est rare, mais la recherche de tumeur testiculaire, de thymome, de cancer pulmonaire à petites cellules ou de lymphome de Hodgkin doit être systématique puisque ces associations sont décrites dans la littérature.
Associations virales
Le déclenchement des encéphalites à anticorps anti-NMDA récepteurs en lien avec une encéphalite virale préalable à HSV est suspectée. En effet, comme décrit dans le mécanisme physiopathologique des encéphalites auto-immunes, la lyse neuronale entraînée par l’herpès virus est à l’origine du relargage d’antigènes circulants neuronaux et de la création via l’immunité B d’anticorps dirigés contre les antigènes de surface neuronaux. Environ 30 % des patients touchés par une encéphalite herpétique vont présenter des anticorps anti-NMDA récepteurs et une symptomatologie encéphalitique dans les suites. Des anticorps dirigés contre l’acide gamma-aminobutyrique A (GABA-A) ou contre les récepteurs de la dopamine D2 ont également été décrits dans les suites d’une encéphalite herpétique.
Prise en charge
Immunomodulation et prise en charge tumorale
L’immunomodulation et la prise en charge de la tumeur associée aux encéphalites à anticorps anti-NMDA récepteurs constituent les piliers du traitement de ces syndromes. En l’absence de traitement, la détérioration neurologique progressive et la mort peuvent survenir. Quelques guérisons spontanées ont toutefois été décrites.
Le traitement initial comprend des bolus de méthylprednisolone intraveineux 1 g/jour pendant 5 jours en association avec des échanges plasmatiques ou des immunoglobulines intraveineuses (IgIV) (2 g/kg sur 5 jours). Il n’y a pas à ce jour de supériorité démontrée des IgIV sur les échanges plasmatiques, mais leur administration peut être plus simple chez les patients présentant des dyskinésies ou une dysautonomie [7].
Les traitements de seconde ligne comprennent le rituximab (375 mg/m2 à 2 semaines d’intervalle) ou par cyclophosphamide (750 mg/m2 par mois pendant 4 à 6 mois) (Fig. 15).
L’utilisation du rituximab en première ligne en association avec la méthylprednisolone et les échanges (ou IgIV) est proposée chez les patients présentant un syndrome encéphalitique sévère dans le but de diminuer le risque de rechutes.
La prise en charge tumorale doit bien sûr être associée à l’immunothérapie décrite ci-dessus.
Prise en charge non spécifique
La prise en charge des patients atteints de syndrome encéphalitiques à anticorps anti-NMDA récepteurs peut nécessiter l’admission en unité de soins intensifs ou de réanimation prolongée. La rééducation motrice, oro-verbale et parfois respiratoire est essentielle au pronostic. L’ergothérapie peut être utile aux patients dont les dyskinésies sont importantes. Une prise en charge psychiatrique des symptômes comportementaux peut également être proposée.
Les thérapeutiques antiépileptiques doivent également être réalisées chez les patients présentant des crises.
Pronostic
L’amélioration clinique est la règle après le traitement d’une encéphalite à anticorps anti-NMDA récepteurs pour environ 50 % des patients avec une première ligne seule et pour 80 % des patients après la seconde ligne d’immunosuppression et l’ablation tumorale. La mortalité est d’environ 5 % malgré la prise en charge et les rechutes concernent 12 % des patients.
Les symptômes frontaux (troubles de l’attention, hyperphagie, désinhibition, troubles de la mémoire ou impulsivité) et l’hypersomnie s’améliorent généralement au fil des mois, mais peuvent perdurer. Les troubles cognitifs perdurent d’autant plus que le traitement a été retardé.
Anticorps anti-LGI1
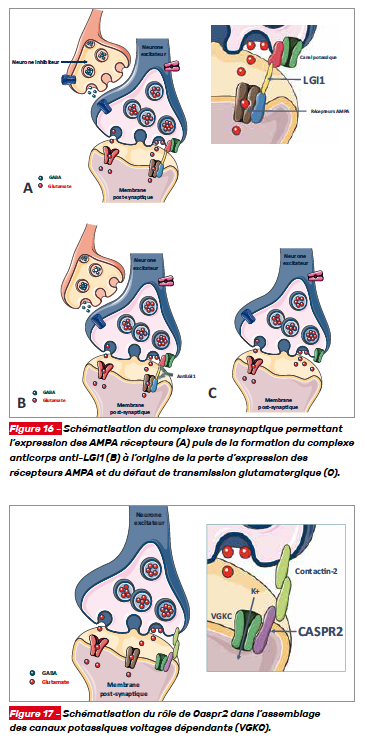
Les anticorps anti-LGI1 (Leucine-rich, glioma inactivated 1) sont retrouvés dans des tableaux encéphalitiques chez des patients présentant des troubles de la mémoire, une confusion et des crises d’épilepsie. La protéine LGI1 est une protéine exprimée principalement au niveau hippocampique qui forme des complexes trans-synaptiques et régule l’expression des récepteurs AMPA impliqués dans la transmission synaptique glutamatergique (Fig. 16). LGI1 fonctionne comme un ligand pour deux protéines ADAM22 et ADAM23 et la liaison des anticorps à LGI1 perturbe la signalisation pré- et post-synaptique à l’origine d’une hyperexcitabilité neuronale [8].
Les patients atteints d’encéphalite à anticorps anti-LGI1 peuvent présenter des troubles de la mémoire et de la cognition en association ou précédés par des crises dystoniques brachiofaciales. La découverte d’une hyponatrémie est évocatrice du diagnostic tout comme les troubles du sommeil à mouvement oculaire rapide (REM).
À l’IRM, l’encéphalite est le plus souvent limbique et l’analyse du LCS est classiquement normale ou ne retrouve que des bandes oligoclonales. Environ 10 % des cas sont associés à des tumeurs dont la plus représentée est le thymome.
L’amélioration clinique est obtenue chez 80 % des patients après un traitement par glucocorticoïdes, IgIV ou échanges plasmatiques +/- mycophénolate mofétil. Les rechutes surviennent chez environ un tiers des patients. Malgré tout, les déficits cognitifs et le handicap persistent chez de nombreux patients dont l’imagerie retrouve des signes d’atrophie hippocampique sévère.
Anticorps anti-Caspr2
L’encéphalite associée à des anticorps anti-Caspr2 (Contactin-associated protein-like 2) peut se manifester sous la forme d’une encéphalite limbique ou d’une neuromyotonie parfois dans le cadre d’un syndrome de Morvan (neuromyotonie, confusion, perte de mémoire, dysautonomie). La cible Caspr2 joue un rôle dans la fonction des canaux potassiques voltages dépendants (VGKC). La liaison de l’anticorps à la cible inhibe l’interaction de Caspr2 avec la contactine-2 et affecte l’assemblage des canaux potassiques principalement au niveau axonal (Fig. 17).
Les présentations cliniques sont variées et les trois quarts de patients présentent au moins trois symptômes parmi les suivants : syndrome cérébelleux, troubles cognitifs, hyperexcitabilité nerveuse périphérique ou douleurs neuropathiques, dysautonomie, insomnie et perte de poids. Les crises d’épilepsie, souvent focales complexes, sont retrouvées chez 30 % des patients. Il n’est pas décrit d’association précise avec un cancer.
Anticorps anti-AMPA récepteurs
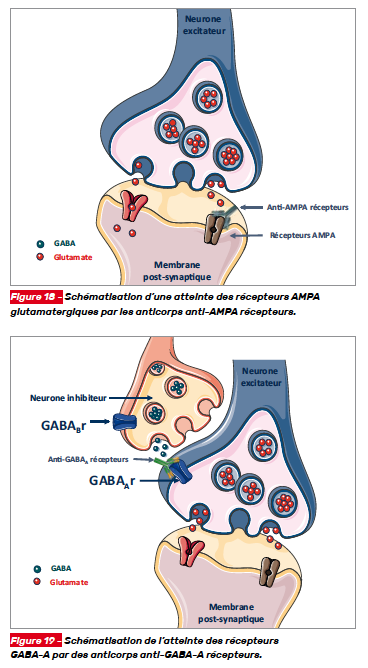
L’encéphalite à anticorps anti-AMPA récepteurs (acide alpha-amino-3-hydroxy-5-méthyl-4-isoxazolepropionique) concerne principalement les femmes entre 50 et 60 ans. Les récepteurs AMPA, glutamatergiques sont les cibles de ces anticorps (Fig. 18). Les encéphalites limbiques sont la règle en association ou non avec des crises d’épilepsie.
L’analyse du LCS montre classiquement une pléiocytose et l’IRM des hypersignaux FLAIR dans les lobes temporaux médians. L’évolution favorable sous immunothérapie et prise en charge tumorale associée est la règle, mais les rechutes sont fréquentes.
Anticorps anti-GABA-A récepteurs
Les encéphalites dirigées contre les récepteurs GABA-A sont rapidement progressives et marquées par des états de mal épileptique (Fig. 19).
L’analyse du LCS montre classiquement une pléiocytose lymphocytaire avec une protéinorachie prononcée. L’IRM montre souvent des hypersignaux FLAIR corticaux et sous-corticaux multifocaux. Les thymomes sont retrouvés chez la plupart des patients. La prise en charge est classiquement marquée par la gestion de l’épilepsie réfractaire en plus de l’immunothérapie et du traitement tumoral. Pour rappel, des cas d’encéphalites à anticorps anti-GABA-A récepteurs ont été rapportés dans les suites d’une encéphalite herpétique.
Anticorps anti-GABA-B récepteurs
Les encéphalites à anticorps anti-GABA-B récepteurs sont marquées par des atteintes limbiques avec parfois des particularités à type de crises, voire d’état de mal épileptique, de démence rapidement progressive, d’ataxie, d’opsoclonies ou de myoclonies. L’analyse du LCS révèle fréquemment une pléiocytose lymphocytaire et une protéinorachie élevée. Elles sont souvent retrouvées en association avec les cancers pulmonaires à petites cellules et la clinique s’améliore avec l’immunothérapie et la prise en charge tumorale.
Anticorps anti-IgLON5
L’IgLON 5 est une protéine d’adhésion cellulaire neuronale qui peut être la cible d’auto-anticorps responsables de neurodégénérescence. Les parasomnies du sommeil paradoxal et non paradoxal ont été mises en évidence dans des cas d’encéphalites anti-IgLON5 et s’ajoutent aux mouvements anormaux et aux troubles de l’équilibre classiquement présentés par les patients. Les signes cliniques principaux comprennent aussi des cas de paralysie supranucléaire progressive, des syndromes bulbaires (dysphagie, sialorrhée, troubles de la cinétique respiratoire), un déclin cognitif et des chorées.
La polysomnographie est importante dans le diagnostic des troubles du sommeil. L’analyse du LCS et l’IRM sont généralement normales.
La réponse à l’immunothérapie est mauvaise et le taux de mortalité est élevé.
Anticorps anti-DPPX
Les patients présentant des anticorps anti-DPPX (dipeptidyl-peptidase-like protein-6) développent une symptomatologie digestive (diarrhées, perte de poids) au premier plan du fait de la représentation importante de ces protéines dans les neurones du tube digestif. Une agitation, des myoclonies, des tremblements et des crises convulsives sont également présents dans l’atteinte encéphalitique de la maladie. L’évolution vers une encéphalomyélite progressive avec rigidité et myoclonies (PERM) est également possible. L’association avec des syndromes lymphoprolifératifs a été retrouvée.
L’analyse du LCS montre une pléiocytose lymphocytaire inconstante et l’IRM n’est généralement pas spécifique. La réponse à l’immunothérapie est bonne, mais les rechutes sont fréquentes.
Anticorps anti-glycine récepteurs
Les anticorps anti-glycine récepteurs (récepteur inotrope aux courants de chlorures) sont associés au syndrome de PERM et au syndrome de l’homme raide. Quelques cas d’encéphalite limbique ou d’atteinte du tronc cérébral ont également été décrits. La réponse à l’immunothérapie est généralement bonne.
Anticorps anti-mGLuR5 récepteurs
Les encéphalites dirigées contre les récepteurs métabotropiques du glutamate de type 5 (mGLuR5) sont volontairement limbique et accompagnées de troubles du mouvement, de troubles du sommeil et de crises d’épilepsie. Le tableau neuropsychiatrique est en général très présent. Des céphalées et une prosopagnosie (non-reconnaissance des visages) doivent également faire évoquer le diagnostic.
L’analyse du LCS met en évidence une pléiocytose lymphocytaire et l’IRM révèle classiquement des hypersignaux FLAIR des régions limbiques.
La réponse à l’immunothérapie et au traitement tumoral (lymphome de Hodgkin ou cancer pulmonaire à petites cellules) est généralement excellente.
Anticorps anti-mGLuR1 récepteurs
Une ataxie cérébelleuse associée à des troubles cognitifs, des crises ou des symptômes psychiatriques doit orienter vers la présence dans le LCS d’anticorps anti-mGLuR1 récepteurs.
L’analyse du LCS montre généralement une pléiocytose associée à des bandes oligoclonales ou une augmentation de l’indice IgG. L’IRM cérébrale est en général normale ou peut montrer des anomalies cérébelleuses avec une atteinte leptoméningée.
Ces anticorps ne sont généralement pas associés à des cancers et la maladie peut s’améliorer si l’immunothérapie est débutée précocement. Les rechutes sont fréquentes en cas d’arrêt de l’immunothérapie. L’évolution vers l’atrophie cérébelleuse est possible.
Anticorps anti-neurexine-3 alpha
La neurexine-3 alpha est une molécule d’adhésion intercellulaire synaptique dont l’atteinte auto-immune peut provoquer des encéphalites sévères avec troubles de la conscience, dyskinésies orofaciales et hypoventilation centrale qui les fait se confondre avec certaines encéphalites à anticorps anti-NMDA récepteurs.
L’analyse du LCS montre une pléiocytose avec un indice IgG élevé. L’IRM est normale ou peut montrer des atteintes temporales internes.
Anticorps anti-GFAP
Les anticorps anti-GFAP (protéine d’acides fibrillaires gliales) sont dirigés contre des protéines filamentaires astrocytaires. Ils sont un marqueur d’encéphalite auto-immune récidivante. Des céphalées, des névrites optiques, des dysautonomies, des tremblements et des troubles psychiatriques sont retrouvés dans des encéphalopathies associées à ces anticorps.
Anticorps anti-DOPA-2 récepteurs
Les anticorps anti-DOPA-2 récepteurs sont retrouvés dans des tableaux parkinsoniens associés à des troubles psychiatriques.
Approches thérapeutiques
Comme discuté au cours des précédents chapitres spécifiques, l’immunosuppression est la pierre angulaire du traitement des encéphalites à médiations immunitaires. Son introduction ne doit pas attendre la découverte des anticorps, ni la preuve du cancer associé.
À ce jour, il n’existe pas d’essai randomisé contrôlé sur l’immunothérapie. Les encéphalites paranéoplasiques sont secondaires à des lésions neuronales médiées par une réponse cellulaire cytotoxique T et sont rarement réversibles. La récupération neurologique attendue est alors limitée, voire nulle en dehors de l’encéphalite à anti-Ma2. Le traitement proposé associe les glucocorticoïdes, les IgIV ou les échanges plasmatiques, le cyclophosphamide ou le rituximab sur le modèle de traitements des encéphalites à anticorps anti-neuropiles (Fig. 15).
A contrario, les encéphalites auto-immunes répondent souvent au traitement puisque les symptômes sont secondaires à des atteintes réversibles des cibles (inactivation, internalisation de récepteurs…). La guérison est la règle. Les titres des anticorps ne sont pas prédictifs de l’évolution de la maladie [9].
Les thérapeutiques non spécifiques associent les mesures de réanimation pour la suppléance ventilatoire ou la gestion hémodynamique des dysautonomies, la protection cutanée et des muqueuses dans les dyskinésies prononcées ou les syndromes parapsychiatriques bruyants (morsure de langue, morsure des doigts…). Les crises épileptiques doivent être traitées de manière agressive à la phase aiguë et les antiépileptiques ne sont généralement pas maintenus au long terme.
Conclusion
Les encéphalites à médiation immunitaire comprennent les encéphalites paranéoplasiques et les encéphalites auto-immunes. Ces deux syndromes peuvent associer une dysimmunité à des cancers et leur terminologie est donc trompeuse. Les premières sont liées à des anticorps dirigés contre les antigènes intracellulaires neuronaux alors que les secondes sont liées à des anticorps dirigés contre les antigènes de surface neuronaux. Ces encéphalites touchent le système limbique, le tronc cérébral, le cervelet ou encore la moelle spinale et ont une présentation aiguë ou subaiguë généralement associée à une inflammation du LCS et des anomalies de signal IRM en séquence FLAIR. Les liens avec les cancers sont étroits et doivent être recherchés activement dans les deux types syndromiques. L’EEG, la ponction lombaire et l’IRM sont les piliers diagnostiques de ces syndromes et permettent l’élimination de la plupart des diagnostics différentiels infectieux, vasculaires et les pathologies démyélinisantes, métaboliques ou toxiques. La prise en charge tumorale et l’immunosuppression sont la règle dans ces syndromes et offrent une possibilité de récupération importante en cas d’encéphalite auto-immune. La réponse est moindre dans les atteintes paranéoplasiques puisque les lésions neuronales par l’immunité cellulaire sont classiquement irréversibles. L’immunosuppression peut être débutée en l’absence de confirmation diagnostique après avoir éliminé les diagnostics infectieux. L’association des glucocorticoïdes aux IgIV (ou échanges plasmatiques) constitue le traitement de première ligne. Les traitements de support, notamment anti-épileptiques, sont généralement indispensables en cas de crise. Certaines associations immunosuppressives diminuent le risque de rechute. Ces tableaux neurologiques parfois complexes associant des troubles parapsychiatriques doivent absolument être évoqués sur point d’appel clinique pour prendre en charge le plus rapidement possible et limiter au maximum les séquelles cognitivo-comportementales à long terme.
Figures réalisées à l’aide de SMART SERVIER
Correspondance
pa.pioche@ch-moulins-yzeure.fr
L’auteur déclare ne pas avoir de lien d’intérêt.
Bibliographie
1. Venkatesan A, Tunkel AR, Bloch KC et al. Case definitions, diagnostic algorithms, and priorities in encephalitis: consensus statement of the international encephalitis consortium. Clin Infect Dis 2013 ; 57 : 1114-28.
2. Dalmau J, Graus F. Antibody-Mediated Encephalitis. N Engl J Med 2018 ; 378 : 840-51.
3. Gultekin SH, Rosenfeld MR, Voltz R et al. Paraneoplastic limbic encephalitis: neurological symptoms, immunological findings and tumour association in 50 patients. Brain 2000 ; 123 : 1481-94.
4. Dalmau J, Graus F, Rosenblum MK, Posner JB. Anti-Hu–associated paraneoplastic encephalomyelitis/sensory neuronopathy. A clinical study of 71 patients. Medicine (Baltimore) 1992 ; 71 : 59-72.
5. Dalmau J, Gleichman AJ, Hughes EG et al. Anti-NMDA-receptor encephalitis: case series and analysis of the effects of antibodies. Lancet Neurol 2008 ; 7 : 1091-8.
6. Schmitt SE, Pargeon K, Frechette ES et al. Extreme delta brush: a unique EEG pattern in adults with anti-NMDA receptor encephalitis. Neurology 2012 ; 79 : 1094-100.
7. Titulaer MJ, McCracken L, Gabilondo I et al. Treatment and prognostic factors for long-term outcome in patients with anti-NMDA receptor encephalitis: an observational cohort study. Lancet Neurol 2013 ; 12 : 157-65.
8. Lancaster E, Martinez-Hernandez E, Dalmau J. Encephalitis and antibodies to synaptic and neuronal cell surface proteins. Neurology 2011 ; 77 : 179-89.
9. Abboud H, Probasco JC, Irani S et al. Autoimmune encephalitis: proposed best practice recommendations for diagnosis and acute management. J Neurol Neurosurg Psychiatry 2021 ; 92 : 757-68.