La Société française d’études des migraines et céphalées (SFEMC) a publié des recommandations de prise en charge de la migraine de l’adulte en 2021 [1-3]. Depuis ces publications, il y a eu de nombreux changements dans l’approche thérapeutique avec disparition du marché de la flunarizine en octobre 2023, l’arrivée depuis l’été 2023 de l’eptinézumab (Vyepti®), produit de la réserve hospitalière, donc sans charge financière pour le patient (mais pas pour l’hôpital) qui s’administre en IV tous les 3 mois chez les patients migraineux sévères, l’arrivée des gépants, à savoir le rimégépant (Vydura®) depuis la fin d’été 2023 en comprimé à 75 mg, non remboursé, pour le traitement de la crise migraineuse chez les patients en échec pour cause d’inefficacité ou d’effets secondaires ou ayant une contre-indication vasculaire aux triptans, sachant que le rimégépant peut être utilisé en traitement préventif, avec une prise 1 jour sur 2. L’atogépant (Aquipta®), traitement de fond de la migraine, devrait être disponible avant fin 2024 et ne devrait pas non plus être remboursé à son lancement. Autre fait notable depuis mai 2023 : l’impossibilité pour les médecins généralistes de prescrire du topiramate aux femmes en âge de procréer sans qu’elles aient pu être vues par un neurologue qui aura alors établi, le cas échéant, un accord annuel de soins étant donné le risque potentiel de troubles neurodéveloppementaux chez son enfant si elle continue le topiramate pendant une grossesse. Par ailleurs, à noter les grosses difficultés d’approvisionnement depuis juillet 2023 avec une quasi-rupture depuis l’hiver 2024 (fin de production déguisée du fait d’une absence de rentabilité financière suffisante ?) de l’oxérotone (Nocertone®) de la part du laboratoire Sanofi.
Les nouveautés dans le traitement de crise
Association fixe sumatriptan-naproxène sodique
Un moyen d’optimiser le traitement de la crise migraineuse est la combinaison triptan-AINS comme déjà évoquée dans nos recommandations de 2021. À court terme, une association fixe sumatriptan 85 mg-naproxène sodique 500 mg (Nomanesit®) sera disponible en France. Les études pivotales de cette association versus sumatriptan seul ou naproxène seul ont montré une meilleure efficacité sur le soulagement à 2 heures, les signes associés (phono-photophobie et troubles digestifs) et une moindre récurrence, le tout avec une bonne tolérance [4].
Gépants
Il s’agit d’une nouvelle classe de traitement spécifique de la migraine. Ce sont des antagonistes des récepteurs du CGRP (Calcitonin gene releated peptid) qui est une protéine ubiquitaire, très abondante dans le cerveau, fabriquée par tous les mammifères, dont les actions physiologiques sont la vasodilatation des petites artères et la transmission nociceptive. Or les migraineux ont un taux plasmatique plus élevé et une plus grande sensibilité au CGRP. Ces traitements oraux (comprimés) sont déjà disponibles dans de nombreux pays.
Leur particularité est d’être utilisables en traitement de crise et/ou en traitement de fond.
Le rimégépant (Vydura®, laboratoire Pfizer) a prouvé son efficacité dans le traitement de la crise et son utilité en traitement de fond [5, 6]. Il a été lancé sur le marché français en octobre 2023, en traitement de crise, mais n’est pas remboursé avec un prix libre variant de 40 à 80 euros le comprimé. Il s’agit d’un traitement intéressant pour les migraineux ne répondant pas aux triptans ou ayant une mauvaise tolérance de cette classe ou ayant des contre-indications d’ordre vasculaire.
Les nouveautés dans le traitement de fond
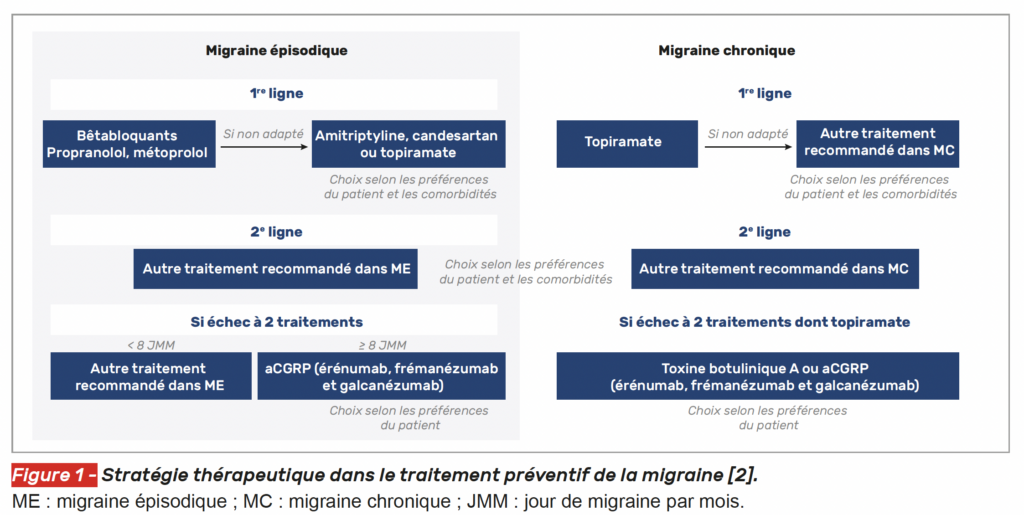
La stratégie du traitement de fond selon les recommandations françaises de 2021 est exposée dans la figure 1.
Du fait du risque avéré de troubles neurodéveloppementaux (augmentation d’un facteur 3 du risque d’autisme chez des enfants exposés pendant la grossesse), le topiramate ne peut plus être initié par les médecins généralistes en traitement préventif de la migraine chez les femmes en activité génitale sauf si ces patientes ont été vues en consultation par un neurologue avec nécessité d’un accord de soins annuels signé avec, dans ce cas, possibilité de renouveler les ordonnances pour 1 an [7-10]. Or le topiramate est le traitement oral au plus haut niveau de preuves dans la migraine chronique (défini par des céphalées au moins 15 jours/mois depuis plus de 3 mois et avec au moins huit paroxysmes migraineux).
Depuis 2021, une étude a suggéré que le propranolol serait aussi efficace dans la migraine chronique [11].
C’est donc le traitement de 1re ligne (sauf contre-indications) dans la migraine épisodique et chronique.
Dans le choix des traitements de fond de la migraine épisodique figure le candésartan qui a un niveau de preuves de grade A, mais qui n’a pas d’AMM spécifique migraine. La dose recommandée à atteindre progressivement est de 16 mg/j [2].
À court terme : les gépants
Comme mentionné plus haut le rimégépant (Vydura®, laboratoire Pfizer) a également une AMM dans le traitement préventif de la migraine [6]. Il n’est pas non plus remboursé dans cette indication avec un prix libre également.
Nous devrions avoir avant fin 2024 l’atogépant (Aquipta®, laboratoire Abbvie) en traitement préventif [12, 13] qui est également un antagoniste oral des récepteurs du CGRP. Ce traitement a obtenu son AMM européenne en août 2023. Il ne sera pas non plus a priori remboursé à son lancement. Son prix n’est pas connu au moment de la rédaction de cet article.
Les anticorps monoclonaux ciblant la voie du CGRP
➔ Galcanézumab (Emgality®, laboratoire Lilly), frémanézumab (Ajovy®, laboratoire Teva), eptinézumab (Vyepti®, laboratoire Lundbeck) qui ciblent le CGRP ou les anti-récepteurs du CGRP tel l’érénumab (Aimovig®, laboratoire Novartis).
Ces derniers constituent une avancée considérable dans la prise en charge des migraineux sévères [14-16, 17-19].
On rappelle que l’AMM européenne de ces traitements concerne les patients ayant 4 jours ou plus de céphalées migraineuses par mois.
Pour des raisons économiques, le remboursement de ces traitements concerne les patients ayant plus de 8 jours de céphalées migraineuses par mois et en échec d’au moins deux traitements de fond à haut niveau de preuves dans les pays qui le remboursent, donc soit 23 pays européens… sauf la France (sic !).
Emgality® et Ajovy® sont disponibles depuis respectivement mars et juillet 2021 en officine de ville. Aimovig® a un agrément collectivité, mais n’est pas disponible en officine de ville en France. Vyepti® est un produit de la réserve hospitalière disponible depuis début 2023. Ce sont des biothérapies qui s’administrent une fois par mois en stylo auto-injecteur en SC sauf pour l’eptinézumab qui s’administre en IV tous les 3 mois et qui est un produit de la réserve hospitalière. Leur efficacité est très importante (80 % des patients bénéficient d’une réduction de la fréquence des crises d’au moins 50 à 75 % avec des crises résiduelles souvent moins sévères). La tolérance est très bonne (possible constipation et douleur modérée au point d’injection). Ces traitements ne modifient pas l’immunité, mais viennent bloquer le CGRP ou son récepteur. Le CGRP est une petite protéine de 37 acides aminés. Tous les mammifères en fabriquent. Ses deux actions physiologiques sont de vasodilater de petites artères et de générer de la douleur. Les migraineux ont un taux plasmatique intercritique plus élevé de CGRP et sont plus sensibles à cette protéine (une injection IV déclenche une crise). Les anti-CGRP sont très efficaces et bien tolérés.
À noter que depuis leur AMM dans le monde, des effets secondaires non connus dans les essais de phase III ont été notifiés : augmentation discrète des chiffres de pression artérielle de l’ordre de 5 mmHg pour la systolique et 2 à 3 mmHg pour la diastolique [20], alopécie chez 0,6 % des femmes [21], syndrome de Raynaud [22].
Ces molécules ont une AMM en France, mais seuls Emgality® et Ajovy® sont disponibles en officine de ville, mais aucun n’est remboursé (prix respectif conseillé qui est un prix libre, donc négociable avec son pharmacien : 245 euros/mois et 270 euros/mois) contrairement à 23 autres pays européens. Les formes sous-cutanées ont un agrément en collectivité et en théorie, peuvent être prescrits à l’hôpital, mais sans budgétisation de ces traitements. Ils ne peuvent être prescrits que par les neurologues. La forme IV (eptinézumab) ne peut être utilisée qu’en hôpital de jour (HDJ), avec perfusions tous les trimestres, avec prise en charge financière par l’hôpital, mais avec une « liste d’attente » importante, car nécessitant des lits d’HDJ et avec une rentabilité financière à peine à l’équilibre, ce qui fait que de grosses structures ayant des centres migraine experts, comme l’AP-HP (Paris), les hospices civils de Lyon n’en disposent pas faute d’accord de leur direction ! Leur mise à disposition pour les patients marseillais est remise en cause pour l’APHM !
À noter que, depuis 3 ans, de multiples actions (contact épistolaire pour faire part de cette situation ubuesque à chaque nouveau ministre de la Santé, et ils ont été nombreux ; pétition en ligne avec l’aide d’associations de patients ; questions diverses posées par des députés ou sénateurs au gouvernement lors de séances du mercredi à l’Assemblée nationale, etc.) ont été menées pour que nous ne soyons plus « l’exception française » dans le mauvais sens du terme… Las…
La toxine botulique de type A : Botox®
Il s’agit d’un médicament utilisé depuis longtemps dans certains mouvements anormaux ou dystoniques. Dans la migraine chronique, qui est sa seule indication [2] (pas dans la migraine épisodique et pas dans les céphalées de tension), il est utilisé depuis plus de 10 ans dans de très nombreux pays. Il a eu, enfin, une extension d’AMM en France dans l’indication migraine chronique, depuis l’été 2021. Il ne peut être prescrit que par un médecin formé aux injections et connaissant bien les indications et uniquement en cas d’échecs d’au moins deux traitements de fond conventionnels. C’est un produit de la réserve hospitalière et les injections se font tous les 3 mois à l’hôpital (prise en charge financière totale pour le patient). Il s’administre selon le protocole PREEMPT (31 à 39 sites d’injection avec 155 à 195 unités de Botox® à chaque séance). Il faut au moins deux cycles d’injections pour juger du résultat. La tolérance est très bonne.
La SFEMC est en phase de rédaction finale de révisions de ces recommandations avec une position forte, sur des considérations purement scientifiques, d’utilisation des traitements ciblant la voie du CGRP, anticorps ou gépants, chez les patients ayant au moins 4 jours de migraine par mois à l’instar de ce que viennent de publier nos collègues nord-américains [6].
Correspondance
christian.lucas@chu-lille.fr
L’auteur déclare avoir les liens d’intérêt suivants : Abbvie, Isis Médicale, Lilly, Lundbeck, Homeperf, SOS oxygène, Orion, Pfizer, Teva.
Bibliographie
1. Demarquay G, Moisset X, Lantéri-Minet M et al. Revised guidelines of the French Headache Society for the diagnosis and management of migraine in adults. Part 1 : Diagnosis and assessment. Rev Neurol 2021 ; 177 : 725–33.
2. Ducros A, de Gaalon S, Roos C et al. Revised guidelines of the French headache society for the diagnosis and management of migraine in adults. Part 2 : Pharmacological treatment. Rev Neurol 2021 ; 177 : 734–52.
3. Demarquay G, Mawet J, Guégan-Massardier E et al. Revised guidelines of the French headache society for the diagnosis and management of migraine in adults. Part 3 : Non-pharmacological treatment. Rev Neurol 2021 ; 177 : 753–9.
4. Law S, Derry S, Moore RA. Sumatriptan plus naproxen for the treatment of acute migraine attacks in adults. Cochrane Database Syst Rev 2016 ; 4 : CD008541.
5. Lipton RB, Croop R, Stock EG et al. Rimegepant, an oral calcitonin gene-related peptide receptor antagonist, for migraine. N Engl J Med 2019 ; 381 : 142–9.
6. Croop R, Lipton RB, Kudrow D et al. Oral rimegepant for preventive treatment of migraine: a phase 2/3, randomised, double-blind, placebo-controlled trial. Lancet Lond Engl 2021 ; 397 : 51–60.
7. Bjørk M-H, Zoega H, Leinonen MK et al. Association of prenatal exposure to antiseizure medication with risk of autism and intellectual disability. JAMA Neurol 2022 ; 79 : 672–81.
8. Actualité – Topiramate et risques chez les enfants exposés pendant la grossesse : modification des conditions de prescription et de délivrance aux femmes concernées. ANSM n.d. https://ansm.sante.fr/actualites/topiramate-et-risques-chez-les-enfants-exposes-pendant-la-grossesse-modification-des-conditions-de-prescription-et-de-delivrance-aux-femmes-concernees-5 (accessed February 15, 2024).
9. Hernández-Díaz S, Straub L, Bateman BT et al. Risk of autism after prenatal topiramate, valproate, or lamotrigine exposure. N Engl J Med 2024 ; 390 : 1069–79.
10. Dreier JW, Bjørk M-H, Alvestad S et al. Prenatal exposure to antiseizure medication and incidence of childhood- and adolescence-onset psychiatric disorders. JAMA Neurol 2023 ; 80 : 568–77.
11. Chowdhury D, Bansal L, Duggal A et al. TOP-PRO study: A randomized double-blind controlled trial of topiramate versus propranolol for prevention of chronic migraine. Cephalalgia Int J Headache 2022 ; 42 : 396–408.
12. Ailani J, Lipton RB, Goadsby PJ et al. Atogepant for the preventive treatment of migraine. N Engl J Med 2021 ; 385 : 695–706.
13. Pozo-Rosich P, Ailani J, Ashina M et al. Atogepant for the preventive treatment of chronic migraine (PROGRESS): a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet Lond Engl 2023 ; 402 : 775–85.
14. Edvinsson L. CGRP and migraine: from bench to bedside. Rev Neurol 2021 ; 177 : 785–90.
15. Sacco S, Amin FM, Ashina M et al. European Headache Federation guideline on the use of monoclonal antibodies targeting the calcitonin gene related peptide pathway for migraine prevention – 2022 update. J Headache Pain 2022 ; 23 : 67.
16. Charles AC, Digre KB, Goadsby PJ et al. Calcitonin gene-related peptide-targeting therapies are a first-line option for the prevention of migraine: An American Headache Society position statement update. Headache 2024 ; 64 : 333-41.
17. Ferrari MD, Diener HC, Ning X et al. Fremanezumab versus placebo for migraine prevention in patients with documented failure to up to four migraine preventive medication classes (FOCUS): a randomised, double-blind, placebo-controlled, phase 3b trial. Lancet Lond Engl 2019 ; 394 : 1030–40.
18. Mulleners WM, Kim B-K, Láinez MJA et al. Safety and efficacy of galcanezumab in patients for whom previous migraine preventive medication from two to four categories had failed (CONQUER): a multicentre, randomised, double-blind, placebo-controlled, phase 3b trial. Lancet Neurol 2020 ; 19 : 814–25.
19. Ashina M, Lanteri-Minet M, Pozo-Rosich P et al. Safety and efficacy of eptinezumab for migraine prevention in patients with two-to-four previous preventive treatment failures (DELIVER): a multi-arm, randomised, double-blind, placebo-controlled, phase 3b trial. Lancet Neurol 2022 ; 21 : 597–607.
20. de Vries Lentsch S, van der Arend BWH, Maassen VanDenBrink A, Terwindt GM. Blood pressure in patients with migraine treated with monoclonal anti-cgrp (receptor) antibodies: a prospective follow-up study. Neurology 2022 ; 99 : e1897–904.
21. Ruiz M, Cocores A, Tosti A, Goadsby PJ, Monteith TS. Alopecia as an emerging adverse event to CGRP monoclonal antibodies: Cases Series, evaluation of FAERS, and literature review. Cephalalgia Int J Headache 2023 ; 43 : 3331024221143538.
22. Gérard AO, Merino D, Van Obberghen EK et al. Calcitonin gene-related peptide-targeting drugs and Raynaud’s phenomenon: a real-world potential safety signal from the WHO pharmacovigilance database. J Headache Pain 2022 ; 23 : 53.