Approche multidisciplinaire du diagnostic des troubles cognitifs
Par Stéphanie Bombois
 L’enjeu actuel dans le domaine des troubles cognitifs est de déterminer de façon précoce et précise l’étiologie de ces difficultés. Le diagnostic précoce permet, entre autres, une meilleure adhésion du patient à son parcours de soin, la mise en place de stratégies de prévention et la possibilité de participer à des essais thérapeutiques innovants.
L’enjeu actuel dans le domaine des troubles cognitifs est de déterminer de façon précoce et précise l’étiologie de ces difficultés. Le diagnostic précoce permet, entre autres, une meilleure adhésion du patient à son parcours de soin, la mise en place de stratégies de prévention et la possibilité de participer à des essais thérapeutiques innovants.
Déterminer l’étiologie des troubles cognitifs correspond, dans les pathologies neurodégénératives, à reconnaître la protéinopathie associée aux déficits cliniques. Les symptômes cognitifs ne sont pas suffisamment spécifiques d’une étiologie (par exemple la maladie d’Alzheimer peut se présenter sous divers phénotypes cliniques : amnésique, aphasie progressive primaire ou atrophie corticale postérieure) et l’utilisation de biomarqueurs est alors utile pour le diagnostic étiologique.
Le diagnostic étiologique fiable est d’autant plus important que des traitements disease-modifier pourraient prochainement être disponibles.
 Les biomarqueurs sont des outils du diagnostic étiologique. Pour le diagnostic de la maladie d’Alzheimer, il existe des biomarqueurs de neurodégénérescence (N) comme l’atrophie hippocampique en IRM ou les troubles du métabolisme glucidique en TEP-FDG avec un hypométabolisme des carrefours pariéto-temporaux. Les lésions pathologiques de la maladie d’Alzheimer sont les plaques amyloïdes (A) et les dépôts de protéines tau hyperphosphorylées (T). Ces lésions peuvent être diagnostiquées par l’imagerie métabolique ou par leur dosage dans les fluides tels que le liquide cérébrospinal (LCS) ou dans le plasma [1]. Des radioligands des dépôts amyloïdes et des protéines tau couplés à l’imagerie TEP permettent de mettre en évidence in vivo les lésions pathologiques de la maladie d’Alzheimer. Ces techniques ne sont pas utilisées dans le soin courant en France (pas d’agrément de collectivité pour les ligands amyloïdes, pas d’AMM pour les ligands tau). Le profil des biomarqueurs du LCS en lien avec une maladie d’Alzheimer biologique repose sur une diminution de concentration du peptide Aβ42 (ou une augmentation du ratio Aβ40/42), une augmentation des protéines P-tau et T-tau. En 2018, le National Institute on Aging et l’Alzheimer’s Association (NIA-AA) ont proposé une définition et un diagnostic de maladie d’Alzheimer s’appuyant sur les critères ATN [2]. Un diagnostic purement biologique de maladie d’Alzheimer pourrait ainsi être porté, quel que soit le stade asymptomatique ou clinique de la maladie.
Les biomarqueurs sont des outils du diagnostic étiologique. Pour le diagnostic de la maladie d’Alzheimer, il existe des biomarqueurs de neurodégénérescence (N) comme l’atrophie hippocampique en IRM ou les troubles du métabolisme glucidique en TEP-FDG avec un hypométabolisme des carrefours pariéto-temporaux. Les lésions pathologiques de la maladie d’Alzheimer sont les plaques amyloïdes (A) et les dépôts de protéines tau hyperphosphorylées (T). Ces lésions peuvent être diagnostiquées par l’imagerie métabolique ou par leur dosage dans les fluides tels que le liquide cérébrospinal (LCS) ou dans le plasma [1]. Des radioligands des dépôts amyloïdes et des protéines tau couplés à l’imagerie TEP permettent de mettre en évidence in vivo les lésions pathologiques de la maladie d’Alzheimer. Ces techniques ne sont pas utilisées dans le soin courant en France (pas d’agrément de collectivité pour les ligands amyloïdes, pas d’AMM pour les ligands tau). Le profil des biomarqueurs du LCS en lien avec une maladie d’Alzheimer biologique repose sur une diminution de concentration du peptide Aβ42 (ou une augmentation du ratio Aβ40/42), une augmentation des protéines P-tau et T-tau. En 2018, le National Institute on Aging et l’Alzheimer’s Association (NIA-AA) ont proposé une définition et un diagnostic de maladie d’Alzheimer s’appuyant sur les critères ATN [2]. Un diagnostic purement biologique de maladie d’Alzheimer pourrait ainsi être porté, quel que soit le stade asymptomatique ou clinique de la maladie.
 Cas clinique. Un homme de 84 ans, retraité, mécanicien, avec pour antécédents personnels : HTA, épisodes dépressifs récurrents en 1982 et 2017, cardiopathie ischémique, cancer de prostate. Son traitement : ticagrelor, bisoprolol, acétylsalicylate de lysine, atorvastatine, bromazépam. Pas d’antécédents familiaux.
Cas clinique. Un homme de 84 ans, retraité, mécanicien, avec pour antécédents personnels : HTA, épisodes dépressifs récurrents en 1982 et 2017, cardiopathie ischémique, cancer de prostate. Son traitement : ticagrelor, bisoprolol, acétylsalicylate de lysine, atorvastatine, bromazépam. Pas d’antécédents familiaux.
Depuis 15 ans, il se plaint d’oublis. Pas de modification de caractère, pas de trouble de l’humeur, troubles du sommeil en raison d’une nycturie. Son examen neurologique est normal. Le bilan neuropsychologique montre un MMSE à 21/30 avec un syndrome amnésique sévère touchant la mémoire épisodique verbale et non verbale avec un trouble de l’encodage, du stockage et de la récupération des informations. Il n’a pas de trouble instrumental. Il existe un syndrome dysexécutif modéré avec une BREF à 11/18 (batterie rapide d’efficience frontale). Il est autonome pour les actes de la vie quotidienne.
Ce profil cognitif fait évoquer en première hypothèse une maladie d’Alzheimer prodromale, et un bilan étiologique est organisé en ce sens. L’IRM montre une atrophie très sévère des hippocampes (classée sur l’échelle visuelle de Scheltens entre 3 et 4), la TEP-FDG montre un hypométabolisme isolé des deux hippocampes, et la ponction lombaire ne montre pas d’anomalie de concentration des trois marqueurs testés.
Le diagnostic étiologique n’est donc pas en faveur d’une maladie d’Alzheimer, ce qui est retrouvé jusqu’à 30 % des cas de sujets avec un syndrome amnésique.
 Suite à la proposition d’un diagnostic biologique par le NIA-AA [2] dans un cadre de la recherche, rapidement se sont posées des questions pour une application en soin courant. L’International Working Group (IWG) a répondu en soulevant des limites à un diagnostic purement biologique et en proposant des recommandations pour le diagnostic de maladie d’Alzheimer dans une perspective de pratique clinique [3].
Suite à la proposition d’un diagnostic biologique par le NIA-AA [2] dans un cadre de la recherche, rapidement se sont posées des questions pour une application en soin courant. L’International Working Group (IWG) a répondu en soulevant des limites à un diagnostic purement biologique et en proposant des recommandations pour le diagnostic de maladie d’Alzheimer dans une perspective de pratique clinique [3].
Les limites d’un diagnostic purement biologique sont liées au fait que l’expression clinique des lésions cérébrales de maladie d’Alzheimer est probablement modulée ou compensée par des facteurs encore peu connus, que la copathologie est très fréquente et qu’il peut être difficile d’associer des symptômes avec les différentes lésions présentes, et qu’il n’existe pas (ou peu) de biomarqueurs de protéinopathies non Alzheimer.
 Selon l’IWG [3], les situations dans lesquelles les biomarqueurs peuvent être utilisés pour le diagnostic de maladie d’Alzheimer sont essentiellement les sujets symptomatiques. Chez les sujets avec une plainte cognitive sans trouble objectivé, il est recommandé dans le cadre du soin de réaliser un suivi clinique et neuropsychologique. Il est recommandé d’utiliser les biomarqueurs chez ces sujets dans le cadre de la recherche, avec une information éclairée sur les résultats qui peuvent découler de leur recherche. Les personnes sans trouble cognitif objectif avec des marqueurs de maladie d’Alzheimer sont considérés comme à risque, mais pas comme ayant une maladie d’Alzheimer (qui pourrait ne pas devenir symptomatique).
Selon l’IWG [3], les situations dans lesquelles les biomarqueurs peuvent être utilisés pour le diagnostic de maladie d’Alzheimer sont essentiellement les sujets symptomatiques. Chez les sujets avec une plainte cognitive sans trouble objectivé, il est recommandé dans le cadre du soin de réaliser un suivi clinique et neuropsychologique. Il est recommandé d’utiliser les biomarqueurs chez ces sujets dans le cadre de la recherche, avec une information éclairée sur les résultats qui peuvent découler de leur recherche. Les personnes sans trouble cognitif objectif avec des marqueurs de maladie d’Alzheimer sont considérés comme à risque, mais pas comme ayant une maladie d’Alzheimer (qui pourrait ne pas devenir symptomatique).
 Les examens pouvant être proposés en pratique courante aux sujets symptomatiques vont dépendre de plusieurs facteurs : de la disponibilité de l’outil, de son coût, de la situation clinique, du souhait du patient à connaître son diagnostic… Il est recommandé en premier lieu une évaluation clinique et neuropsychologique, suivie par une imagerie structurelle. Si une maladie d’Alzheimer est l’hypothèse principale, une ponction lombaire avec dosages des biomarqueurs du LCS pourra être proposée préférentiellement à une TEP-FDG, alors que dans le cas d’une suspicion de pathologie dégénérative non Alzheimer, il pourra être proposé en premier lieu une TEP-FDG [4].
Les examens pouvant être proposés en pratique courante aux sujets symptomatiques vont dépendre de plusieurs facteurs : de la disponibilité de l’outil, de son coût, de la situation clinique, du souhait du patient à connaître son diagnostic… Il est recommandé en premier lieu une évaluation clinique et neuropsychologique, suivie par une imagerie structurelle. Si une maladie d’Alzheimer est l’hypothèse principale, une ponction lombaire avec dosages des biomarqueurs du LCS pourra être proposée préférentiellement à une TEP-FDG, alors que dans le cas d’une suspicion de pathologie dégénérative non Alzheimer, il pourra être proposé en premier lieu une TEP-FDG [4].
Bibliographie
1. Scheltens P, De Strooper B, Kivipelto M et al. Alzheimer’s disease. Lancet 2021 ; 10284 : 1577-90.
2. Jack CR Jr, Bennett DA, Blennow K et al. NIA–AA research framework: toward a biological definition of Alzheimer’s disease. Alzheimers Dement 2018 ; 14 : 535–62.
3. Dubois B, Villain N, Frisoni GB et al. Clinical diagnosis of Alzheimer’s disease: recommendations of the International Working Group. Lancet Neurol 2021 ; 6 : 484-96.
4. Chételat G, Arbizu J, Barthel H et al. Amyloid-PET and 18 F-FDG-PET in the diagnostic investigation of Alzheimer’s disease and other dementias. Lancet Neurol 2020 ; 11 : 951-62.
Impact de l’imagerie métabolique dans la prise en charge des syndromes parkinsoniens atypiques
Par Florence Le Jeune
 L’imagerie métabolique est une technique d’imagerie fonctionnelle fondée sur la détection de traceurs radioactifs. Elle donne des informations complémentaires de l’imagerie morphologique et en particulier de l’IRM. Différents processus moléculaires d’intérêt peuvent être étudiés en imagerie métabolique. Certains sont peu spécifiques, en particulier l’étude du métabolisme glucidique avec le traceur 18F-FDG. Sa captation est liée aux besoins énergétiques en glucose du neurone et est corrélée à l’activité synaptique. Elle est altérée dans la plupart des pathologies cérébrales fonctionnelles. D’autres sont plus spécifiques, et en particulier les traceurs qui permettent l’étude du versant présynaptique de la synapse dopaminergique. Il existe deux types de traceurs : un traceur dit anatomique, le Datscan®, marqueur des transporteurs dopaminergiques au niveau du versant présynaptique de la synapse, et l’autre plutôt enzymatique, la 18F-DOPA, au niveau de la synthèse de la dopamine.
L’imagerie métabolique est une technique d’imagerie fonctionnelle fondée sur la détection de traceurs radioactifs. Elle donne des informations complémentaires de l’imagerie morphologique et en particulier de l’IRM. Différents processus moléculaires d’intérêt peuvent être étudiés en imagerie métabolique. Certains sont peu spécifiques, en particulier l’étude du métabolisme glucidique avec le traceur 18F-FDG. Sa captation est liée aux besoins énergétiques en glucose du neurone et est corrélée à l’activité synaptique. Elle est altérée dans la plupart des pathologies cérébrales fonctionnelles. D’autres sont plus spécifiques, et en particulier les traceurs qui permettent l’étude du versant présynaptique de la synapse dopaminergique. Il existe deux types de traceurs : un traceur dit anatomique, le Datscan®, marqueur des transporteurs dopaminergiques au niveau du versant présynaptique de la synapse, et l’autre plutôt enzymatique, la 18F-DOPA, au niveau de la synthèse de la dopamine.
 L’AMM des deux traceurs de la synapse dopaminergique porte sur leur capacité à distinguer un syndrome parkinsonien dégénératif versus un tremblement essentiel. Dans le cadre des démences, seul le Datscan® a l’AMM pour le diagnostic différentiel entre démence à corps de Lewy (DCL) probable et maladie d’Alzheimer (MA). La recherche en TEP au 18F-FDG des patterns hypométaboliques corrélés au phénotype clinique ne permet pas toujours de faire ce diagnostic différentiel. Dans ces deux pathologies, on retrouve des hypométabolismes assez diffus temporo-pariétaux bilatéraux avec possible extension frontale. Seule l’étude de la synapse dopaminergique permet de différencier une DCL où il existera une atteinte dopaminergique présynaptique et une MA où le Datscan® sera normal.
L’AMM des deux traceurs de la synapse dopaminergique porte sur leur capacité à distinguer un syndrome parkinsonien dégénératif versus un tremblement essentiel. Dans le cadre des démences, seul le Datscan® a l’AMM pour le diagnostic différentiel entre démence à corps de Lewy (DCL) probable et maladie d’Alzheimer (MA). La recherche en TEP au 18F-FDG des patterns hypométaboliques corrélés au phénotype clinique ne permet pas toujours de faire ce diagnostic différentiel. Dans ces deux pathologies, on retrouve des hypométabolismes assez diffus temporo-pariétaux bilatéraux avec possible extension frontale. Seule l’étude de la synapse dopaminergique permet de différencier une DCL où il existera une atteinte dopaminergique présynaptique et une MA où le Datscan® sera normal.
 Dans le cadre des autres syndromes parkinsoniens atypiques, l’intérêt de l’analyse combinée de l’étude du métabolisme glucidique et de la dénervation dopaminergique présynaptique a été largement publié. Dans tous les cas de syndromes parkinsoniens atypiques, il existe une dénervation dopaminergique présynaptique souvent bilatérale sur les striatum et parfois marquée comme dans la paralysie supra-nucléaire (PSP) avec une augmentation du bruit de fond signant une diminution de la fixation spécifique. Avec la TEP au 18F-FDG, on recherche des patterns hypométaboliques plus “spécifiques”. Ces patterns sont différents selon la pathologie sous-jacente et décrits dans le tableau ci-contre.
Dans le cadre des autres syndromes parkinsoniens atypiques, l’intérêt de l’analyse combinée de l’étude du métabolisme glucidique et de la dénervation dopaminergique présynaptique a été largement publié. Dans tous les cas de syndromes parkinsoniens atypiques, il existe une dénervation dopaminergique présynaptique souvent bilatérale sur les striatum et parfois marquée comme dans la paralysie supra-nucléaire (PSP) avec une augmentation du bruit de fond signant une diminution de la fixation spécifique. Avec la TEP au 18F-FDG, on recherche des patterns hypométaboliques plus “spécifiques”. Ces patterns sont différents selon la pathologie sous-jacente et décrits dans le tableau ci-contre.
 Ce premier cas concerne le bilan d’un syndrome parkinsonien atypique chez une femme de 57 ans. Elle présente un syndrome extrapyramidal d’évolution rapide, gauche, mixte depuis juillet 2019 avec une mauvaise tolérance aux agonistes de la Dopa. Le neurologue consulté suspecte un syndrome parkinsonien atypique de type PSP ou DCL puisqu’il existe une instabilité précoce avec chutes et lenteur oculomotrice, mais aussi des fluctuations et des troubles du sommeil paradoxal. L’IRM morphologique est considérée comme normale. Que peut-on envisager comme bilan d’imagerie métabolique ?
Ce premier cas concerne le bilan d’un syndrome parkinsonien atypique chez une femme de 57 ans. Elle présente un syndrome extrapyramidal d’évolution rapide, gauche, mixte depuis juillet 2019 avec une mauvaise tolérance aux agonistes de la Dopa. Le neurologue consulté suspecte un syndrome parkinsonien atypique de type PSP ou DCL puisqu’il existe une instabilité précoce avec chutes et lenteur oculomotrice, mais aussi des fluctuations et des troubles du sommeil paradoxal. L’IRM morphologique est considérée comme normale. Que peut-on envisager comme bilan d’imagerie métabolique ?
 Dans ce cas précis où le syndrome parkinsonien clinique semble évident, une TEP au 18F-FDG a été réalisée afin de rechercher le pattern hypométabolique plus spécifique de la PSP ou de la DCL. Une première lecture a été considérée comme normale, mais devant l’aggravation clinique rapide, la TEP a été relue. Des hypométabolismes modérés au niveau frontal mésial ont été mis en évidence. La fixation du striatum était également hétérogène. Le diagnostic de PSP est suspecté.
Dans ce cas précis où le syndrome parkinsonien clinique semble évident, une TEP au 18F-FDG a été réalisée afin de rechercher le pattern hypométabolique plus spécifique de la PSP ou de la DCL. Une première lecture a été considérée comme normale, mais devant l’aggravation clinique rapide, la TEP a été relue. Des hypométabolismes modérés au niveau frontal mésial ont été mis en évidence. La fixation du striatum était également hétérogène. Le diagnostic de PSP est suspecté.
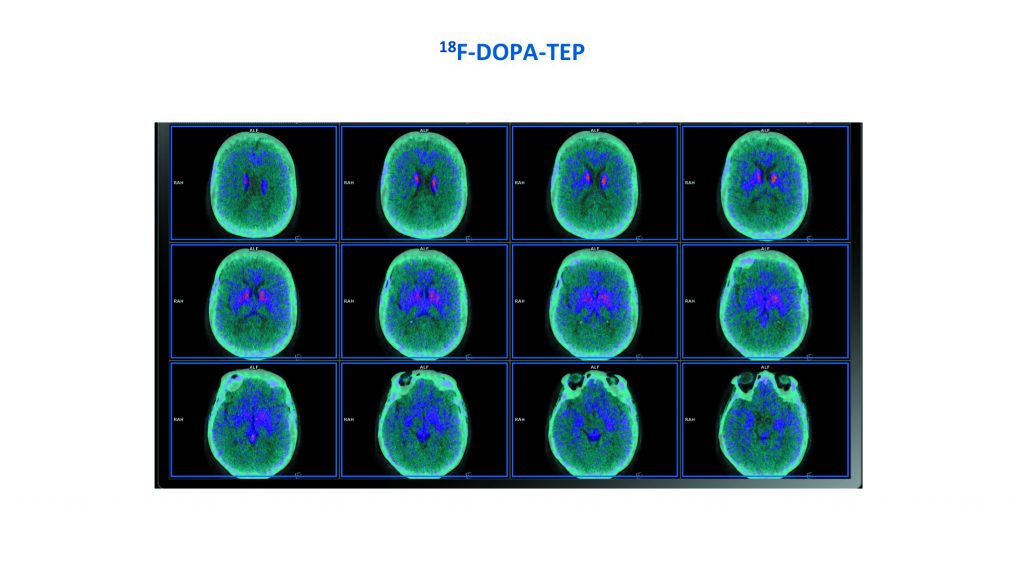 Chez cette femme jeune, avec une suspicion de PSP, les cliniciens ont décidé de confirmer l’atteinte dopaminergique. Une TEP à la 18F-DOPA a été réalisée et montre une atteinte dopaminergique présynaptique bilatérale majeure avec diminution importante de la fixation du striatum et augmentation de la fixation du bruit de fond. En routine clinique, quand un neurologue suspecte une PSP, il est intéressant qu’il le précise dans le bon d’examen, car les anomalies sont souvent modérées et nécessitent d’être recherchées.
Chez cette femme jeune, avec une suspicion de PSP, les cliniciens ont décidé de confirmer l’atteinte dopaminergique. Une TEP à la 18F-DOPA a été réalisée et montre une atteinte dopaminergique présynaptique bilatérale majeure avec diminution importante de la fixation du striatum et augmentation de la fixation du bruit de fond. En routine clinique, quand un neurologue suspecte une PSP, il est intéressant qu’il le précise dans le bon d’examen, car les anomalies sont souvent modérées et nécessitent d’être recherchées.
 L’imprégnation à certains médicaments, les plus connus sont les neuroleptiques et la Dépakine®, peut entraîner l’apparition de syndromes parkinsoniens « like ». Le diagnostic clinique est souvent difficile à réaliser et pourtant les conséquences thérapeutiques peuvent être importantes. L’examen du versant présynaptique de la synapse dopaminergique permet de faire ce diagnostic différentiel. Dans le cas de Mme S, 63 ans, présentant des troubles de l’humeur anciens traités par neuroleptiques, le Datscan® est normal et permet de continuer le traitement. Par contre, dans le cas de Mme L, 62 ans, présentant des troubles bipolaires anciens traités par Dépakine®, le Datscan® apparaît très pathologique avec une diminution de la fixation globale des striatum et une augmentation majeure du bruit de fond. Cet examen montre donc une atteinte dopaminergique présynaptique bilatérale assez marquée et est en faveur de l’existence d’un syndrome parkinsonien dégénératif sous-jacent. Chez cette patiente, un traitement par Modopar® a été débuté et la Dépakine® a été substituée par le Lamictal®, permettant une amélioration clinique sur le plan moteur et une stabilité thymique.
L’imprégnation à certains médicaments, les plus connus sont les neuroleptiques et la Dépakine®, peut entraîner l’apparition de syndromes parkinsoniens « like ». Le diagnostic clinique est souvent difficile à réaliser et pourtant les conséquences thérapeutiques peuvent être importantes. L’examen du versant présynaptique de la synapse dopaminergique permet de faire ce diagnostic différentiel. Dans le cas de Mme S, 63 ans, présentant des troubles de l’humeur anciens traités par neuroleptiques, le Datscan® est normal et permet de continuer le traitement. Par contre, dans le cas de Mme L, 62 ans, présentant des troubles bipolaires anciens traités par Dépakine®, le Datscan® apparaît très pathologique avec une diminution de la fixation globale des striatum et une augmentation majeure du bruit de fond. Cet examen montre donc une atteinte dopaminergique présynaptique bilatérale assez marquée et est en faveur de l’existence d’un syndrome parkinsonien dégénératif sous-jacent. Chez cette patiente, un traitement par Modopar® a été débuté et la Dépakine® a été substituée par le Lamictal®, permettant une amélioration clinique sur le plan moteur et une stabilité thymique.
 L’imagerie métabolique apparaît indiquée dans le cadre du bilan des syndromes parkinsoniens atypiques pour confirmer l’atteinte dopaminergique présynaptique et rechercher des patterns pouvant évoquer et apporter un faisceau d’arguments en faveur de l’un des différents syndromes parkinsoniens. Elle entre dans le cadre d’une approche diagnostique multidisciplinaire et, en permettant d’aider au diagnostic différentiel, de mieux adapter la prise en soin des patients.
L’imagerie métabolique apparaît indiquée dans le cadre du bilan des syndromes parkinsoniens atypiques pour confirmer l’atteinte dopaminergique présynaptique et rechercher des patterns pouvant évoquer et apporter un faisceau d’arguments en faveur de l’un des différents syndromes parkinsoniens. Elle entre dans le cadre d’une approche diagnostique multidisciplinaire et, en permettant d’aider au diagnostic différentiel, de mieux adapter la prise en soin des patients.
L’intérêt de cette analyse complémentaire du métabolisme glucidique et de l’atteinte dopaminergique présynaptique est évident dans le cadre de l’AMM (DCL vs MA), pour différencier une PSP vs DFT vs MA et devant des patients présentant une imprégnation aux médicaments responsables de syndromes parkinsoniens « like ».
Impact diagnostique et thérapeutique de l’imagerie pour les patients porteurs d’une pathologie psychiatrique
Par Gabriel Robert
 En psychiatrie, a fortiori, auprès de personnes âgées, l’intrication des troubles psychiatriques, cognitifs et dégénératifs sont fréquents. En effet, les symptômes psychiatriques de type dépression, anxiété, apathie, voire changements insidieux de personnalité sont des modes d’entrée très fréquents dans les maladies dégénératives, avant les premiers symptômes cognitifs et/ou moteurs. Bien souvent, ces tableaux sont marqués par des caractéristiques atypiques et par une fréquence élevée d’événements indésirables lors de la prise de psychotropes. Les examens paracliniques permettent en cas de doutes cliniques de réorienter les diagnostics, même si, parfois, ils ne retrouvent pas les atteintes observées lors des tableaux typiques. Voici un cas clinique d’une patiente âgée suivie pour dépression chronique et résistante.
En psychiatrie, a fortiori, auprès de personnes âgées, l’intrication des troubles psychiatriques, cognitifs et dégénératifs sont fréquents. En effet, les symptômes psychiatriques de type dépression, anxiété, apathie, voire changements insidieux de personnalité sont des modes d’entrée très fréquents dans les maladies dégénératives, avant les premiers symptômes cognitifs et/ou moteurs. Bien souvent, ces tableaux sont marqués par des caractéristiques atypiques et par une fréquence élevée d’événements indésirables lors de la prise de psychotropes. Les examens paracliniques permettent en cas de doutes cliniques de réorienter les diagnostics, même si, parfois, ils ne retrouvent pas les atteintes observées lors des tableaux typiques. Voici un cas clinique d’une patiente âgée suivie pour dépression chronique et résistante.
 Mme B, 89 ans, est adressée par son médecin traitant pour dépression chronique et cure d’électroconvulsivothérapie. Le premier courrier retrace les éléments psychiatriques. Les antécédents familiaux (encadré rouge 1) et les premiers symptômes apparus ou étant aggravés par les décès successifs de son mari et de son fils orientent plutôt vers une origine psychiatrique. Le discours et la plainte anxieuse de la patiente confortent cette hypothèse. Cependant, la multirésistance et l’intolérance aux traitements, bien que fréquentes et aspécifiques, doivent alerter sur un mode d’entrée dans une maladie dégénérative.
Mme B, 89 ans, est adressée par son médecin traitant pour dépression chronique et cure d’électroconvulsivothérapie. Le premier courrier retrace les éléments psychiatriques. Les antécédents familiaux (encadré rouge 1) et les premiers symptômes apparus ou étant aggravés par les décès successifs de son mari et de son fils orientent plutôt vers une origine psychiatrique. Le discours et la plainte anxieuse de la patiente confortent cette hypothèse. Cependant, la multirésistance et l’intolérance aux traitements, bien que fréquentes et aspécifiques, doivent alerter sur un mode d’entrée dans une maladie dégénérative.
 Au cours de son suivi, la patiente est adressée vers plusieurs neurologues. L’absence de syndrome extrapyramidal axial trompe l’examinateur. Un autre élément est la lente évolution du tableau moteur. Le ralentissement psychomoteur et l’amimie sont mis sur le compte de la dépression chronique et résistante. L’IRM ne montre pas d’atteinte spécifique. Une dopathérapie est mise en place à titre de test diagnostique, mais il n’y aura pas d’amélioration clinique sur le plan moteur ou bien de l’équilibre.
Au cours de son suivi, la patiente est adressée vers plusieurs neurologues. L’absence de syndrome extrapyramidal axial trompe l’examinateur. Un autre élément est la lente évolution du tableau moteur. Le ralentissement psychomoteur et l’amimie sont mis sur le compte de la dépression chronique et résistante. L’IRM ne montre pas d’atteinte spécifique. Une dopathérapie est mise en place à titre de test diagnostique, mais il n’y aura pas d’amélioration clinique sur le plan moteur ou bien de l’équilibre.
 Les stratégies thérapeutiques psychiatriques suivent les recommandations de la dépression chronique et résistante. Elle bénéficie d’un protocole de stimulation magnétique transcrânienne répétée dans le cadre de protocole de recherche, d’abord avec une stimulation à haute fréquence du cortex préfrontal dorso-latéral gauche, puis avec un protocole de stimulation intermittente en thêta-burst. Ce protocole de stimulation permet de délivrer un plus grand nombre de stimulation en un temps réduit et a montré des espoirs dans la tolérance de cette technique avec une efficacité non inférieure à un protocole de stimulation à haute fréquence. Malheureusement, aucune de ces deux tentatives n’a permis d’améliorer la situation globale de la patiente. Elle bénéficie encore d’une pharmacothérapie composée de faibles posologies d’antidépresseurs et d’anxiolytiques. Progressivement, le tableau d’apathie, d’amimie et surtout la perte d’autonomie deviennent plus sévères. Un DAT-Scan est alors réalisé.
Les stratégies thérapeutiques psychiatriques suivent les recommandations de la dépression chronique et résistante. Elle bénéficie d’un protocole de stimulation magnétique transcrânienne répétée dans le cadre de protocole de recherche, d’abord avec une stimulation à haute fréquence du cortex préfrontal dorso-latéral gauche, puis avec un protocole de stimulation intermittente en thêta-burst. Ce protocole de stimulation permet de délivrer un plus grand nombre de stimulation en un temps réduit et a montré des espoirs dans la tolérance de cette technique avec une efficacité non inférieure à un protocole de stimulation à haute fréquence. Malheureusement, aucune de ces deux tentatives n’a permis d’améliorer la situation globale de la patiente. Elle bénéficie encore d’une pharmacothérapie composée de faibles posologies d’antidépresseurs et d’anxiolytiques. Progressivement, le tableau d’apathie, d’amimie et surtout la perte d’autonomie deviennent plus sévères. Un DAT-Scan est alors réalisé.
 Celui-ci montre une atteinte sévère et marquée de la densité de transporteur de la dopamine au niveau des deux putamens (flèches rouges) avec une augmentation de la fixation du bruit de fond, signant ainsi une réduction importante de la fixation spécifique du traceur.
Celui-ci montre une atteinte sévère et marquée de la densité de transporteur de la dopamine au niveau des deux putamens (flèches rouges) avec une augmentation de la fixation du bruit de fond, signant ainsi une réduction importante de la fixation spécifique du traceur.
 Une consultation auprès d’un neurologue spécialisé dans les mouvements anormaux confirme une paralysie supranucléaire progressive avec des troubles axiaux, une atteinte du système nerveux végétatif et une paralysie de la verticalité du regard. En conclusion, l’atypicité des symptômes psychiatriques (multirésistance et mauvaise tolérance aux psychotropes), mais aussi moteurs (faible dopa-sensibilité, évolution lente et atteinte axiale prédominante) ont retardé le diagnostic. L’imagerie métabolique permet de statuer clairement sur une atteinte dopaminergique et oriente vers un diagnostic clinique avec un nouvel œil.
Une consultation auprès d’un neurologue spécialisé dans les mouvements anormaux confirme une paralysie supranucléaire progressive avec des troubles axiaux, une atteinte du système nerveux végétatif et une paralysie de la verticalité du regard. En conclusion, l’atypicité des symptômes psychiatriques (multirésistance et mauvaise tolérance aux psychotropes), mais aussi moteurs (faible dopa-sensibilité, évolution lente et atteinte axiale prédominante) ont retardé le diagnostic. L’imagerie métabolique permet de statuer clairement sur une atteinte dopaminergique et oriente vers un diagnostic clinique avec un nouvel œil.
Tumeurs du SNC : du diagnostic au traitement
Par Antoine Girard
 L’imagerie métabolique par TEP est maintenant largement disponible en routine clinique. En complément de l’IRM, elle permet de répondre à de multiples problématiques en neuro-oncologie. Concernant les tumeurs gliales, la TEP aux acides aminés (principalement à la 18F-DOPA en France) est l’examen de choix. Lors du diagnostic initial, une captation intense objectivée sur la TEP à la 18F-DOPA permettra d’affirmer la transformation maligne avec une forte spécificité, bien qu’une faible captation ne permette pas de l’exclure. Le site de captation le plus intense (« point chaud ») pourra servir de cible en cas de biopsie afin de permettre une juste évaluation du grade tumoral. Dans le cadre de la planification du traitement chirurgical ou par radiothérapie, la TEP à la 18F-DOPA apporte des informations complémentaires à celles de l’IRM pour l’évaluation du volume tumoral total et du volume de haut grade dans les lésions hétérogènes. Dans l’illustration présentée, la TEP à la 18F-DOPA mettait en évidence une lésion avec une captation intense du traceur (2,4 fois supérieure à celle du cortex sain) dont l’extension controlatérale était plus importante que celle visualisée sur l’IRM. La biopsie révéla un glioblastome pléomorphe de grade IV de l’OMS sans mutation du gène IDH.
L’imagerie métabolique par TEP est maintenant largement disponible en routine clinique. En complément de l’IRM, elle permet de répondre à de multiples problématiques en neuro-oncologie. Concernant les tumeurs gliales, la TEP aux acides aminés (principalement à la 18F-DOPA en France) est l’examen de choix. Lors du diagnostic initial, une captation intense objectivée sur la TEP à la 18F-DOPA permettra d’affirmer la transformation maligne avec une forte spécificité, bien qu’une faible captation ne permette pas de l’exclure. Le site de captation le plus intense (« point chaud ») pourra servir de cible en cas de biopsie afin de permettre une juste évaluation du grade tumoral. Dans le cadre de la planification du traitement chirurgical ou par radiothérapie, la TEP à la 18F-DOPA apporte des informations complémentaires à celles de l’IRM pour l’évaluation du volume tumoral total et du volume de haut grade dans les lésions hétérogènes. Dans l’illustration présentée, la TEP à la 18F-DOPA mettait en évidence une lésion avec une captation intense du traceur (2,4 fois supérieure à celle du cortex sain) dont l’extension controlatérale était plus importante que celle visualisée sur l’IRM. La biopsie révéla un glioblastome pléomorphe de grade IV de l’OMS sans mutation du gène IDH.
 La radionécrose est une complication fréquente de la radiothérapie cérébrale qui survient le plus souvent dans les 3 ans après la fin du traitement. La TEP aux acides aminés peut compléter l’IRM pour différencier une récidive tumorale d’une radionécrose lorsque cette dernière met en évidence une prise de contraste nouvelle ou se majorant d’interprétation équivoque. Dans le cas présenté ici la faible captation de 18F-DOPA sur le site de prise de contraste orientait plutôt vers une radionécrose que vers une récidive tumorale. La régression de la prise de contraste dans le suivi confirma l’absence de récidive.
La radionécrose est une complication fréquente de la radiothérapie cérébrale qui survient le plus souvent dans les 3 ans après la fin du traitement. La TEP aux acides aminés peut compléter l’IRM pour différencier une récidive tumorale d’une radionécrose lorsque cette dernière met en évidence une prise de contraste nouvelle ou se majorant d’interprétation équivoque. Dans le cas présenté ici la faible captation de 18F-DOPA sur le site de prise de contraste orientait plutôt vers une radionécrose que vers une récidive tumorale. La régression de la prise de contraste dans le suivi confirma l’absence de récidive.
 La TEP aux acides aminés présente une exactitude diagnostique comprise entre 82 et 93 % lorsqu’elle complète une IRM non conclusive dans cette indication. Dans le cas illustré, la captation intense de 18F-DOPA (supérieure à deux fois celle du cortex sain) sur la lésion temporale droite permettait de conclure à une viabilité tumorale. La récidive tumorale a été confirmée après biopsie.
La TEP aux acides aminés présente une exactitude diagnostique comprise entre 82 et 93 % lorsqu’elle complète une IRM non conclusive dans cette indication. Dans le cas illustré, la captation intense de 18F-DOPA (supérieure à deux fois celle du cortex sain) sur la lésion temporale droite permettait de conclure à une viabilité tumorale. La récidive tumorale a été confirmée après biopsie.
 De même, après radiothérapie de métastases cérébrales, la TEP aux acides aminés est également un examen de choix pour différencier la récidive de la radionécrose cérébrale en cas de doute sur l’IRM, avec une sensibilité de 74-90 % et une spécificité de 75-100 %. Cependant, la TEP à la 18F-DOPA ne bénéficie pas d’autorisation de mise sur le marché en France dans cette indication. De plus en plus de centres français proposent la réalisation d’une TEP au 18F-FDG avec acquisition tardive (4 à 5 h après l’injection du traceur) en plus des images standard réalisées 1 h après injection. Cette technique présente des performances diagnostiques du même ordre avec une sensibilité de 93-95 % et une spécificité de 94-100 %.
De même, après radiothérapie de métastases cérébrales, la TEP aux acides aminés est également un examen de choix pour différencier la récidive de la radionécrose cérébrale en cas de doute sur l’IRM, avec une sensibilité de 74-90 % et une spécificité de 75-100 %. Cependant, la TEP à la 18F-DOPA ne bénéficie pas d’autorisation de mise sur le marché en France dans cette indication. De plus en plus de centres français proposent la réalisation d’une TEP au 18F-FDG avec acquisition tardive (4 à 5 h après l’injection du traceur) en plus des images standard réalisées 1 h après injection. Cette technique présente des performances diagnostiques du même ordre avec une sensibilité de 93-95 % et une spécificité de 94-100 %.
 Les méningiomes surexpriment dans leur quasi-totalité les récepteurs à la somatostatine de type 2. La TEP aux analogues des récepteurs à la somatostatine et en particulier au 68Ga-DOTATOC peut être utile pour le diagnostic différentiel avec d’autres lésions cérébrales ne surexprimant pas ces récepteurs (ex : schwanomes), mais également pour définir l’étendue de méningiomes complexes avant traitement chirurgical ou par radiothérapie. Enfin, la TEP au 68Ga-DOTATOC est nécessaire à la sélection des patients avant traitement par analogues des récepteurs à la somatostatine marqués à Lutétium 177 (Lutathéra®). Ce traitement devrait bénéficier dans les mois qui viennent d’un régime temporaire d’autorisation en France pour la prise en charge des méningiomes de grade I et II après échec du traitement de référence (chirurgie, radiothérapie) ou en cas d’impossibilité de le conduire.
Les méningiomes surexpriment dans leur quasi-totalité les récepteurs à la somatostatine de type 2. La TEP aux analogues des récepteurs à la somatostatine et en particulier au 68Ga-DOTATOC peut être utile pour le diagnostic différentiel avec d’autres lésions cérébrales ne surexprimant pas ces récepteurs (ex : schwanomes), mais également pour définir l’étendue de méningiomes complexes avant traitement chirurgical ou par radiothérapie. Enfin, la TEP au 68Ga-DOTATOC est nécessaire à la sélection des patients avant traitement par analogues des récepteurs à la somatostatine marqués à Lutétium 177 (Lutathéra®). Ce traitement devrait bénéficier dans les mois qui viennent d’un régime temporaire d’autorisation en France pour la prise en charge des méningiomes de grade I et II après échec du traitement de référence (chirurgie, radiothérapie) ou en cas d’impossibilité de le conduire.
 Le lymphome primitif cérébral (LPC) est une pathologie rare de diagnostic parfois difficile sur l’IRM. La TEP au 18F-FDG peut être utile pour le diagnostic différentiel du LPC. Elle présente d’excellentes performances tant chez les patients immunodéprimés (versus toxoplasmose, tuberculose, leucoencéphalopathie multifocale progressive…) que chez les patients immunocompétents (versus glioblastome). De plus, l’acquisition d’images du corps entier permet la détection de lésions extra-cérébrales associées avec un rendement diagnostique de 5 %, supérieur à celui du scanner seul. En conclusion, grâce à une large diversité de traceurs disponibles, la TEP est aujourd’hui un examen de choix en complément de l’IRM à chaque étape de la prise en charge des tumeurs cérébrales depuis le diagnostic initial jusqu’à la détection de récidives.
Le lymphome primitif cérébral (LPC) est une pathologie rare de diagnostic parfois difficile sur l’IRM. La TEP au 18F-FDG peut être utile pour le diagnostic différentiel du LPC. Elle présente d’excellentes performances tant chez les patients immunodéprimés (versus toxoplasmose, tuberculose, leucoencéphalopathie multifocale progressive…) que chez les patients immunocompétents (versus glioblastome). De plus, l’acquisition d’images du corps entier permet la détection de lésions extra-cérébrales associées avec un rendement diagnostique de 5 %, supérieur à celui du scanner seul. En conclusion, grâce à une large diversité de traceurs disponibles, la TEP est aujourd’hui un examen de choix en complément de l’IRM à chaque étape de la prise en charge des tumeurs cérébrales depuis le diagnostic initial jusqu’à la détection de récidives.




